题目内容
【题目】某有机物A对氢气的相对密度为29,燃烧该有机物2.9克,生成3.36L(STP)二氧化碳。
(1)求该有机物的分子式;
(2)取0.58克该有机物与足量的银氨溶液反应,析出金属银2.16克。写出该化合物的结构简式。
【答案】
(1) C3H6O;
(2) CH3CH2CHO
【解析】
试题分析:(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,燃烧该有机物2.9g,生成3.36L二氧化碳气体(标况下)、2.7g水,则二氧化碳物质的量=![]() =0.15mol,水的物质的量=
=0.15mol,水的物质的量=![]() =0.15mol,则m(C)+m(H)=0.15mol×12g/mol+0.15mol×2×1g/mol=2.1g<2.9g,故m(O)=2.9g-2.1g=0.8g,n(O)=
=0.15mol,则m(C)+m(H)=0.15mol×12g/mol+0.15mol×2×1g/mol=2.1g<2.9g,故m(O)=2.9g-2.1g=0.8g,n(O)=![]() =0.05mol,故有机物A中C、H、O原子数目之比=0.15mol:0.15mol×2:0.05mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,答:有机物A的分子式为C3H6O;
=0.05mol,故有机物A中C、H、O原子数目之比=0.15mol:0.15mol×2:0.05mol=3:6:1,故有机物A的最简式为C3H6O,最简式的相对分子质量为58,而有机物A的相对分子质量为58,故最简式即为A的分子式,故A的分子式为:C3H6O,答:有机物A的分子式为C3H6O;
(2)0.58g该有机物的物质的量=![]() =0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=
=0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=![]() =0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,故答案为:CH3CH2CHO。
=0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,故答案为:CH3CH2CHO。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
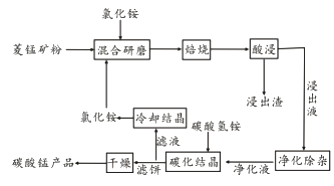
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
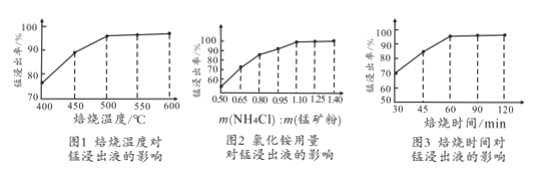
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
