��Ŀ����
(1)����Ag2S(s)  2Ag+(aq)+ S2-(aq)����Ksp=____________(д����ʽ)��
2Ag+(aq)+ S2-(aq)����Ksp=____________(д����ʽ)��
(2)����˵���������_______��
A����ϡ����ϴ��AgCl��������ˮϴ�����AgClС��
B���������ʵ��ܽ�����¶ȵ����߶����ӣ������ʵ��ܽⶼ�����ȵģ�
C������Al(OH)3(s)  Al(OH)3(aq)
Al(OH)3(aq)  Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻
Al3+��3OH-��ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ�⣻
D����ȥ��Һ�е�Mg2+����OH- ����Mg2+ �� ��CO32-Ч���ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3��
��CO32-Ч���ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3��
E��������Ӧ�г��ӹ����ij���������Ŀ����ʹ������ȫ��
(3)��Ȼ��ԭ��ͭ�����ᆳ�������������ú�������CuSO4��Һ����������Һ����ؿ����������п��(ZnS)ʱ���������ת��Ϊͭ��(CuS)[��֪ Ksp(ZnS)=2.93��10-25��Ksp(CuS)=6.3��10-36]���������ֱ仯��ԭ���� ��
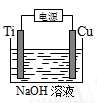
(4)����ͼװ�ã����������¿��Ե���Ʊ�����Cu2O����ӦΪ��2Cu��H2O Cu2O��H2��������ͼ��ʾ���õ��ص�������ӦʽΪ ��
Cu2O��H2��������ͼ��ʾ���õ��ص�������ӦʽΪ ��
 ��У����ϵ�д�
��У����ϵ�д�ijС��ͬѧ��̽��0.1 mol/L Fe3+��Һ�� 0.1 mol/L S2-��Һ�ķ�Ӧ��С��ͬѧ�Ƚ�������Ԥ�⣬����������ֿ��ܣ�
a��Fe3+�� S2-�������ֽⷴӦ
b��Fe3+�� S2-���� ��Ӧ
c��Fe3+�� S2-��������ˮ�ⷴӦ
(1)����Ԥ��a д���÷�Ӧ�����ӷ���ʽ
(2)��Ԥ��b�������� ��˵��Ԥ������ ��
�ڽ���ʵ����֤ǰ���Ƚ��������ռ����õ�������Ϣ��
���� | ��ɫ | ˮ���ܽ��� |
Fe2S3 | ��ɫ | ������ˮ |
FeS | �ں�ɫ | ������ˮ |
��������ʵ�飺
ʵ�鲽�� | ���� | ���� | ��ע |
1 | ��2 mL 0.1 mol/L�Ȼ�����Һ����ε���3��0.1 mol/L ������Һ | ������ɫ������ ������Ϊ��ɫ������δ�������������� | ��ʼ���ն�δ�����ɫ���� |
2 | �����μ�3��0.1 mol/L ������Һ | ͬ�� | |
3 | �����μ�0.1 mol/L ������Һ������ | ������ɫ���������ã�δ�������Ա仯 |
(3)д����ɫ����ת��Ϊ��ɫ���������ӷ���ʽ
Ϊ��һ��̽����Ӧʵ�ʣ�����ͬѧ����������ʵ�飺
ʵ�鲽�� | ���� | ���� |
4 | ��2 mL 0.1 mol/L������Һ����ε���3��0.1 mol/L �Ȼ�����Һ | ������ɫ������δ�������������� |
5 | �����μ�3��0.1 mol/L �Ȼ�����Һ | ͬ�� |
6 | �����μ�0.1 mol/L �Ȼ�����Һ������ | ͬ�� |
(4)����4�벽��1����ͬ��ԭ�������
(5)��ͬѧ��Ϊ����3�в����ĺ�ɫ�����п�����FeS�����ж������뷨�Ƿ������˵������
(6)��������ʵ�����ɵó����ۣ�_________________________��



 2NH3(g)�������ݻ�Ϊ2.0L���ܱ������г���0.60molN2(g)��1.60 mol H2(g)��2min��ij�¶��´ﵽƽ�⣬��ʱNH3�����ʵ�������(NH3�����ʵ����뷴Ӧ��ϵ���ܵ����ʵ���֮��)Ϊ4/7�������(д���������)��
2NH3(g)�������ݻ�Ϊ2.0L���ܱ������г���0.60molN2(g)��1.60 mol H2(g)��2min��ij�¶��´ﵽƽ�⣬��ʱNH3�����ʵ�������(NH3�����ʵ����뷴Ӧ��ϵ���ܵ����ʵ���֮��)Ϊ4/7�������(д���������)��