题目内容
6.将50mL0.5mol•L-1NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )| A. | 0.04 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.04 mol•L-1 |
分析 根据稀释定律,稀释前后溶质NaOH的物质的量不变,据此计算稀释后NaOH溶液的物质的量浓度.
解答 解:令稀释后NaOH溶液的物质的量浓度为c,根据稀释定律,稀释前后溶质NaOH的物质的量不变,则:
0.05L×0.5mol/L=0.5L×c,
解得c=0.05mol/L;
故选C.
点评 本题考查物质的量浓度的有关计算,侧重于稀释定律的应用的考查,题目难度不大,注意对公式的理解与灵活应用.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
16.下列离子方程式书写正确的是( )
| A. | 苯酚与碳酸钠反应:2C6H5OH+CO32-→2C6H5O-+CO2↑+H2O | |
| B. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| C. | Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-═2Fe2++I2+3H2O | |
| D. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr |
17.与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | CH3COOH→CH3COOC2H5 | B. | C2H5Cl→CH2=CH2 | ||
| C. |  | D. | CH3CHO→C2H5OH |
1.下列各组物质中,反应后生成碱和氧气的是( )
| A. | 钾和水 | B. | 氧化钠和水 | C. | 氧化钙和水 | D. | 过氧化钠和水 |
11.A、B、C三种羧酸同足量的碳酸氢钠溶液反应,在相同条件下产生相同体积的二氧化碳消耗这三种羧酸的物质的量之比为3:6:2,则A、B、C三种羧酸分子中羧基数目之比是( )
| A. | 3:2:1 | B. | 2:6:3 | C. | 3:6:2 | D. | 2:1:3 |
18.完成下列各小题
(1)第34号元素符号是Se,铬元素位于元素周期表的d区(填“s、p、d、f、ds),其价层电子的轨道表示式(或电子排布图)为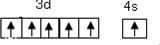
(2)用“>”或“<”填空
(3)在O、Na、P、Cl四种元素中,电负性最大的是O,PCl3的立体构型为三角锥形,中心原子的杂化轨道类型为sp3中心原子的价层电子对数为4
(4)在下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,共有4种(填数字)晶体类型,熔化时不需破坏化学键的是①⑤,(填序号,下同)熔化时只需破坏共价键的是④⑥.
(1)第34号元素符号是Se,铬元素位于元素周期表的d区(填“s、p、d、f、ds),其价层电子的轨道表示式(或电子排布图)为

(2)用“>”或“<”填空
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | O2->Na+ | CaO<MgO | HClO4>H2SO4 |
(4)在下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,共有4种(填数字)晶体类型,熔化时不需破坏化学键的是①⑤,(填序号,下同)熔化时只需破坏共价键的是④⑥.
 V2=50ml)。下列叙述正确的是( )
V2=50ml)。下列叙述正确的是( )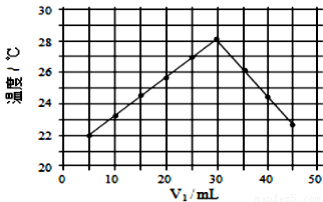
 O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g);ΔH=-282.8 kJ·mol-1