��Ŀ����
��ѧ�о�����������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
��.������ȡCu2O�ķ���
��1����ԭ����̿���ڸ��������»�ԭCuO��
��2����������[CH2OH(CHOH)4CHO]��ԭ���Ƶ�Cu(OH)2��д����ѧ����ʽ���� ��
��3����ⷨ����ӦΪ2Cu + H2O Cu2O + H2������������������������ ��
��4������ʵ���о����£�N2H4����ԭ����Cu(OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ������ ��
��.���Ƶõ�Cu2O���д��ֽ�ˮ��ʵ��
��1��һ���¶��£���2L�ܱ������м�������Cu2O��ͨ��0.10molˮ������������Ӧ��
ʱ��/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
2H2O��g��![]() 2H2��g����O2��g������H = +484kJ?mol-1����ͬʱ�β���O2�������±���
2H2��g����O2��g������H = +484kJ?mol-1����ͬʱ�β���O2�������±���
���㣺
ǰ20min�ķ�Ӧ���� v��H2O��= ������ ���÷�Ӧ��ƽ�ⳣ������ʽK = ������ ����ƽ��ʱ��������Ҫ���յĹ���Ϊ������ kJ��
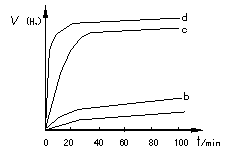
��2�����������ַ����Ƶõ�Cu2O��ij��ͬ�����·ֱ��ˮ���ֽ⣬��������������v��ʱ��t�仯��ͼ��ʾ������������ȷ���������������� �� ��
A��c��d�����Ƶõ�Cu2O��Ч����Խϸ�
B��d�����Ƶõ�Cu2O������ʱ��ˮ��ƽ��ת�������
C����Ч����Cu2O�����Ĵ�ϸ��������Ե��й�
D��Cu2O��ˮ�ֽ�ʱ����Ҫ���˵��¶�
��2��CH2OH(CHOH)4CHO + 2Cu(OH)2 �� CH2OH(CHOH)4COOH+Cu2O��+2H2O
��3��Cu2O��
��4��4Cu(OH)2 + N2H4���� ![]() 2Cu2O + N2 + 6H2O���� (3��)
2Cu2O + N2 + 6H2O���� (3��)
��1��5.0��10�D5 mol?L-1 min�D1 ������(2��)
![]() ������ ����
������ ���� ![]() �������� (2��)������ 0.97�� ��2�֣�
�������� (2��)������ 0.97�� ��2�֣�
��2��ACD (3�֣�ѡ��һ��ֻ��1�֣���ѡһ������1�֣����ٵ�0��)
ע��(��Ч���ִ����λ����1��)

��ѧ�о�����������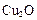 ����Ϊ̫����ֽ�ˮ�Ĵ�����
����Ϊ̫����ֽ�ˮ�Ĵ�����
��������ȡ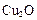 �ķ���
�ķ���
��1����ԭ����̿���ڸ��������»�ԭCuO��
��2����������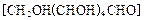 ��ԭ���Ƶ�
��ԭ���Ƶ�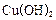 ��д����ѧ����ʽ ��
��д����ѧ����ʽ ��
��3����ⷨ����ӦΪ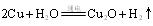 �������������� ��
�������������� ��
��4������ʵ���о����£� ����ԭ����
����ԭ����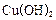 ���Ʊ�����
���Ʊ�����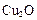 ��ͬʱ�ų�
��ͬʱ�ų�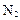 �����Ʒ��Ļ�ѧ����ʽΪ ��
�����Ʒ��Ļ�ѧ����ʽΪ ��
�����Ƶõ�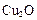 ���д��ֽ�ˮ��ʵ��
���д��ֽ�ˮ��ʵ��
��1��һ���¶��£���2L�ܱ������м�������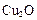 ��ͨ��0��10molˮ������������Ӧ��
��ͨ��0��10molˮ������������Ӧ��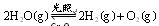 ����H= +484kJ/mol����ͬʱ�β���
����H= +484kJ/mol����ͬʱ�β���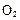 �������±���
�������±���
| ʱ��/min | 20 | 40 | 60 | 80 |
| n��O2��/mol | 0��0010 | 0��0016 | 0��0020 | 0��0020 |
 ����ƽ��ʱ��������Ҫ���յĹ���Ϊ kJ��
����ƽ��ʱ��������Ҫ���յĹ���Ϊ kJ����2�����������ַ����Ƶõ�
 ��ij��ͬ�����·ֱ��ˮ���ֽ⣬��������������v��ʱ��t�仯��ͼ��ʾ������������ȷ���� ��
��ij��ͬ�����·ֱ��ˮ���ֽ⣬��������������v��ʱ��t�仯��ͼ��ʾ������������ȷ���� ��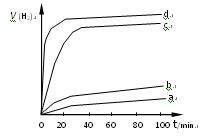
A��c��d�����Ƶõ�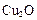 ��Ч����Խϸ� ��Ч����Խϸ� |
B��d�����Ƶõ�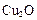 ������ʱ��ˮ��ƽ��ת������� ������ʱ��ˮ��ƽ��ת������� |
C����Ч����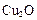 �����Ĵ�ϸ��������Ե��й� �����Ĵ�ϸ��������Ե��й� |
| D��Cu2O��ˮ�ֽ�ʱ����Ҫ���˵��¶� |
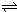 2H2��g��+O2��g����H=+484kJ?mol-1�����20minʱO2�����ʵ���Ϊ0.0016mol����ǰ20min�ķ�Ӧ����v��H2O��=
2H2��g��+O2��g����H=+484kJ?mol-1�����20minʱO2�����ʵ���Ϊ0.0016mol����ǰ20min�ķ�Ӧ����v��H2O��=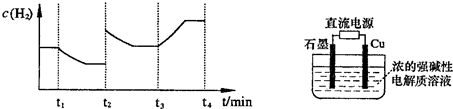

 �¶��£���2 L�ܱ������м�������Cu2O��ͨ��0.20 molˮ������������Ӧ��
�¶��£���2 L�ܱ������м�������Cu2O��ͨ��0.20 molˮ������������Ӧ��
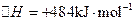 �����20 minʱO2�����ʵ���Ϊ0.0016 mol����ǰ20 min�ķ�Ӧ����v��H2O��= �����¶��£���Ӧ��ƽ�ⳣ������ʽK= ����ͼ��ʾ��t1ʱ�̴ﵽƽ���ֻ�ı�һ�������ִﵽƽ��IJ�ͬʱ���ڣ�H2��Ũ����ʱ��仯���������t1ʱƽ����ƶ�����Ϊ ��t2ʱ�ı����������Ϊ ������K1��K2��K3�ֱ��ʾt1ʱ����ı�����������ʱ����ڵ�ƽ
�����20 minʱO2�����ʵ���Ϊ0.0016 mol����ǰ20 min�ķ�Ӧ����v��H2O��= �����¶��£���Ӧ��ƽ�ⳣ������ʽK= ����ͼ��ʾ��t1ʱ�̴ﵽƽ���ֻ�ı�һ�������ִﵽƽ��IJ�ͬʱ���ڣ�H2��Ũ����ʱ��仯���������t1ʱƽ����ƶ�����Ϊ ��t2ʱ�ı����������Ϊ ������K1��K2��K3�ֱ��ʾt1ʱ����ı�����������ʱ����ڵ�ƽ �ⳣ����t3ʱ��û�м���������ϵ�е��κ����ʣ���K1��K2��K3�Ĺ�ϵΪ ��
�ⳣ����t3ʱ��û�м���������ϵ�е��κ����ʣ���K1��K2��K3�Ĺ�ϵΪ ��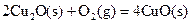 ��H����293kJ��mol��1
��H����293kJ��mol��1 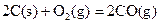 ��H����221kJ��mol��1
��H����221kJ��mol��1