��Ŀ����
����Ŀ���赥�ʼ��仯����Ӧ�úܹ㡣��ش��������⣺
��1���Ʊ���뵼����ϱ����ȵõ��ߴ��衣���ȼ���(SiHCl3)��ԭ���ǵ�ǰ�Ʊ��ߴ������Ҫ��������������ʾ��ͼ���£�![]()
��д���ɴ�SiHCl3�Ʊ��ߴ���Ļ�ѧ��Ӧ����ʽ��
�������Ʊ����̱����ϸ������ˮ��������SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��
HCl����һ�����ʣ�д����ƽ�Ļ�ѧ��Ӧ����ʽ��H2
��ԭSiHCl3������������O2 �� ��������ĺ������
��2�������йع���ϵ�˵����ȷ����( )��
A.���ʹ軯ѧ�����ȶ��������Ա�ǿ����Һ��ʴ
B.���������跴Ӧ���ʲ�������Ϊ��Һ�ⵥ����
C.��ͨ�������ɴ��ʯ��ʯ��ʯӢɰ�Ƴɵģ����۵�ܸ�
D.���ά����Ҫ�ɷ���SiO2
��3��������ˮ��Һ�׳�ˮ������ȡ������������Һ���Թ��У���μ������ᣬ
��д��ʵ�����������(�û�ѧ����ʽ˵��)��
��4�������������ܵ�����ʱ����Ҫʹ��һ���������ǽ���������ֲ�����ڣ����ֲ�����________(����ĸ)��
A.���½ṹ�մ�
B.�����մ�
C.�����մ�
���𰸡�
��1��SiHCl3��H2 ![]() Si��3HCl����SiHCl3��3H2O=H2SiO3��H2����3HCl���������£�H2��O2���ܻ�����ը��O2���ܻ�����SiHCl3
Si��3HCl����SiHCl3��3H2O=H2SiO3��H2����3HCl���������£�H2��O2���ܻ�����ը��O2���ܻ�����SiHCl3
��2��A,D
��3�����ɰ�ɫ��״������Na2SiO3��2HCl=2NaCl��H2SiO3��
��4��B
����������SiHCl3��H2�ڸ����·�Ӧ�õ��ߴ����ͬʱ���ɵõ�HCl����˻�ѧ����ʽΪSiHCl3��H2![]() Si��3HCl����SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HCl����һ�����ʣ����ѵó���һ������Ϊ�������Ӷ�д����Ӧ��ѧ����ʽ������������ʱ�������������ᷢ����Ӧ�����ܻ�����ը�����⣬����Ҳ���ܻ�����SiHCl3��(2)A��D�Ƚϼ�������ȷ��˵����B�У������������ȶ�����������ᷴӦ�������������ᷴӦ��������һ˵���Ǵ���ģ�C��Ҫע�ⲣ���ǻ������߱��̶����۷е㣬����C����(3)��������ȡ���ᣬ���ڹ������ˮ�����Կ��Կ����а�ɫ��״������������Ӧ��ѧ����ʽΪNa2SiO3��2HCl===2NaCl��H2SiO3����(4)����ֲ�������ڣ����ѡ�������մɣ���ѡ��B��
Si��3HCl����SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HCl����һ�����ʣ����ѵó���һ������Ϊ�������Ӷ�д����Ӧ��ѧ����ʽ������������ʱ�������������ᷢ����Ӧ�����ܻ�����ը�����⣬����Ҳ���ܻ�����SiHCl3��(2)A��D�Ƚϼ�������ȷ��˵����B�У������������ȶ�����������ᷴӦ�������������ᷴӦ��������һ˵���Ǵ���ģ�C��Ҫע�ⲣ���ǻ������߱��̶����۷е㣬����C����(3)��������ȡ���ᣬ���ڹ������ˮ�����Կ��Կ����а�ɫ��״������������Ӧ��ѧ����ʽΪNa2SiO3��2HCl===2NaCl��H2SiO3����(4)����ֲ�������ڣ����ѡ�������մɣ���ѡ��B��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
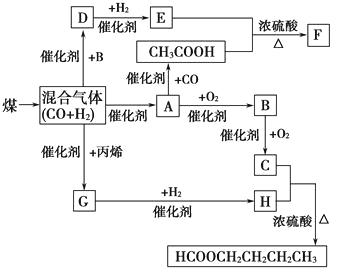
Сѧ��10����Ӧ����ϵ�д�����Ŀ���Ա���ȩΪԭ�ϣ�ͨ��Cannizzaro��Ӧ���Ʊ����״��ͱ����ᣬ��ӦʽΪ��
����Ӧ��
����Ӧ��![]()
��Ҫ���ϵ��������������
���� | ������ | ��״ | ����ܶ� | �е� | �ܽ�� | |
ˮ | ���� | |||||
����ȩ | 106 | ��ɫҺ�� | 1.04 | 179 | �� | ���� |
������ | 122 | ��ɫ���� | 1.27 | 249 | 0.21g | 66g |
���״� | 108 | ��ɫҺ�� | 1.04 | 205 | �� | ���� |
���� | 74 | ��ɫҺ�壮 | 0.71 | 35 | ���� | ���� |
ʵ�鲽�裺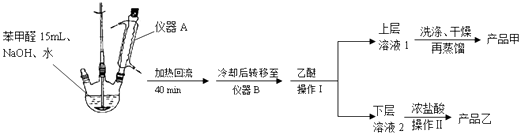
��1������A�������� ��
��2���������ʱ�¶�Ӧ�ÿ��������ң���ò�Ʒ��ʱ���еIJ������������ ��
��3�����ϲ���Һ1�г���������Ҫ�л��������� ��
ϴ��ʱ�Ⱥ��õ��˱���NaHSO3��Һ��10%��NaHCO3��Һ��ˮ��
��ϴ�Ӳ������н��У�
a���ձ� b������©�� c����ƿ d����Һ©��
�ۼ���10%��NaHCO3��Һ����������ʱ˵�������ѱ�������
��4������Ʒ������Ϊ5.40g�����Ʒ�IJ����� ��