��Ŀ����
��15.68L����״��������ͨ��70�桢500mL����������Һ�У���������������������ԭ��Ӧ������������Ϊ�������ƺ������ơ���ȡ����Һ25mLϡ�͵�250mL����ȡϡ��Һ25mL�ô����ữ��������ĵ⻯�س�ַ�Ӧ����ʱֻ�д������������⻯�ء���Ũ��Ϊ0.20mol/L�����������Һ�ζ������ĵ⣺I2+2S2O32-=2I-+S4O62-�����������������Һ5.0mLʱǡ�÷�Ӧ��ȫ�����ζ������Һ���������ǿ���ԣ���ʱ���������������⻯�أ������ĵ������������������Һ�ٵζ���ǡ�÷�Ӧ��ȫ����Ҫ�����������Һ30.0mL����1�����㷴Ӧ����Һ�д������ƺ������Ƶ����ʵ���֮�ȡ�
��2��д�����������������ܷ�Ӧ�Ļ�ѧ����ʽ��
��3������������Һ�������ͨ������ǰ��ı仯���Բ��ƣ�����ͨ�������������������ʵ���Ũ�ȡ�
�������⣬����������������Һ��������������������ԭ��ӦΪ��Cl2+2NaOH=NaCl+NaClO+H2O��3Cl2+6NaOH
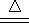 5NaCl+NaClO3+3H2O�������ữ�������������⻯�صĹ�ϵʽΪ��ClO-~2I-~I2��ͬ����ClO3-~6I-~3I2���������������Һ�ζ������ĵⷢ����Ӧ��I2+2S2O32-=2I-+S4O62-���ֱ����ClO-��ClO3-�����ʵ�����
5NaCl+NaClO3+3H2O�������ữ�������������⻯�صĹ�ϵʽΪ��ClO-~2I-~I2��ͬ����ClO3-~6I-~3I2���������������Һ�ζ������ĵⷢ����Ӧ��I2+2S2O32-=2I-+S4O62-���ֱ����ClO-��ClO3-�����ʵ�������1���������⣬�У�
ClO-~2I-~I2~2S2O32- ClO3-~6I-~3I2~6S2O32-
1mol 2mol 1mol 6mol
0.0005 0.20��0.005 0.001 0.20��0.03
��ˣ�n��ClO-����n��ClO3-��=0.0005��0.001=1��2������Ӧ����Һ�д��������������Ƶ����ʵ���֮��Ϊ1��2��
��2�����ݣ�1���ļ����������ܵĻ�ѧ����ʽΪ��7Cl2+14NaOH=11NaCl+NaClO+2NaClO3+7H2O��
��3��ͨ��������n��NaClO��=0.0005mol��250mL/25mL=0.005mol�����c��NaClO��=0.005mol/��25mL��10-3L?mL-1��=0.2mol/L��
�����ܷ�Ӧ�Ļ�ѧ����ʽ�и����ʵ����ʵ����Ĺ�ϵ����c��NaClO3��=2c��NaClO��=2��0.2mol/L=0.4mol/L��c��NaCl��=11c��NaClO��=11��0.2mol/L=2.2mol/L��
�����������

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ