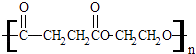题目内容
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒。某兴趣小组进行下面实验探究,查阅资料知道:
①HNO2为弱酸 ;
②2NO+Na2O2=2NaNO2 ;
③2NO2+Na2O2=2NaNO3 ;
④酸性KMnO4溶液可将NO和NO2-均氧化为NO3-,MnO4-还原成Mn2+ 。NaNO2的制备方法可有如下2种方法(夹持装置和加热装置已略,气密性已检验):
(1)在制备装置1中:
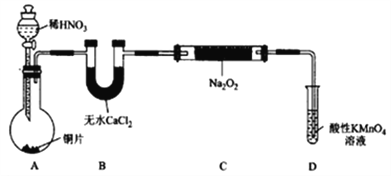
① 如果没有B装置,C中发生的副反应有_________,_________;
② 甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质;于是在A装置与B装置间增加了 ____________装置,改进后提高了NaNO2的纯度;
③ D装置发生反应的离子方程式为 ____________________。
(2)在制备装置2中:
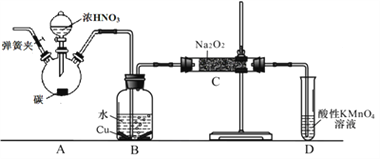
① B装置的作用是 _________________________;
② 写出装置A烧瓶中发生反应的化学方程式并用单线桥标出电子的转移 _____;
③ 为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为 ________;
④根据题中所给信息,设计实验检验装置C中NaNO2的存在时,应使用_________。(填试剂名称)
【答案】 2Na2O2+2H2O = 4NaOH+O2↑ 2NO+O2 = 2NO2 装有水的洗气瓶 5NO + 3MnO4— + 4H+ = 5NO3— + 3Mn2+ + 2H2O 制取NO(或将NO2转化为NO,同时Cu与稀硝酸反应生成NO) 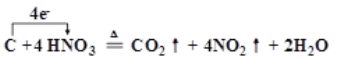 碱石灰(或生石灰或NaOH) 酸性KMnO4溶液
碱石灰(或生石灰或NaOH) 酸性KMnO4溶液
【解析】(1)① 如果没有B装置,水能够与过氧化钠反应生成氢氧化钠和氧气;氧气又能与一氧化氮反应生成二氧化氮。
② 二氧化氮能够与水反应,除去二氧化氮气,提高了NaNO2的纯度。
③ 酸性高锰酸钾溶液能够把一氧化氮氧化为硝酸根离子,本身还原为Mn2+。
(2)① 二氧化氮与水反应生成硝酸和一氧化氮,硝酸再与铜反应生成一氧化氮。
② 碳和浓硝酸加热反应生成二氧化氮、二氧化碳,1molC失去4mole-,该反应转移4mole-,用单线桥表示电子转移。
③ 用碱石灰或氢氧化钠吸收二氧化碳,这样避免了二氧化碳与过氧化钠反应。
④NO2-具有还原性,可以用酸性高锰酸钾溶液检验。
(1)①若没有B装置,则水分不能被吸收,所以在C装置水和过氧化钠会发生反应,化学反应方程式为2Na2O2+2H2O =4NaOH+O2↑;生成的O2还会将NO氧化成NO2,化学反应方程式为2NO+O2 =NO2;正确答案:2Na2O2+2H2O = 4NaOH+O2↑;2NO+O2 = 2NO2。
②制得的NaNO2中混有较多的NaNO3杂质,说明NO与空气中的O2发生了副反应:2NO+O2 = 2NO2, NO2再将Na2O2氧化成了NaNO3,所以可以在AB之间加一个装有水的洗气瓶除去 NO2气体;正确答案:装有水的洗气瓶。
③在D装置尾气处理装置中,未反应的NO被MnO4-氧化生成NO-3, MnO4-被还原成Mn2+,离子方程式为: 5NO + 3MnO4— + 4H+ = 5NO3— + 3Mn2+ + 2H2O;正确答案:5NO + 3MnO4— + 4H+ = 5NO3— + 3Mn2+ + 2H2O。
(2)①A装置中浓硝酸与碳反应生成NO2、CO2和H2O,NO2通入B装置后与H2O反应生成HNO3,HNO3再与Cu反应生成NO,进而可以在C装置中与Na2O2反应,所以装置B的作用是制取NO;正确答案:制取NO(或将NO2转化为NO,同时Cu与稀硝酸反应生成NO)。
②A烧瓶中浓硝酸与碳在加热的条件下生成NO2、CO2和H2O,碳元素由0价升高至+4价,每1molC失去4mole-,HNO3中的N元素化合价降低,得电子,化学方程式和单线桥标出的电子转移为![]() ;正确答案:
;正确答案:![]() 。
。
③A装置中反应的生成物中有CO2,CO2通过B装置后进入C中,和Na2O2发生副反应,所以应该在BC之间再增加一个去除CO2的装置,可选用试剂为碱石灰或生石灰或NaOH;正确答案:碱石灰(或生石灰或NaOH)。
④NO2-具有还原性,可以用酸性高锰酸钾溶液检验,具体的检验方法为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,(加入稀硫酸酸化),滴加入1~2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;正确答案:酸性KMnO4溶液。