题目内容
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为K1;
FeO(s)+CO(g) 平衡常数为K1;
反应②Fe(s)+H2O(g) FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2
测得在不同温度下,K1、K2值如下:
(1)若500℃进行反应①,CO2起始浓度为2mol.L-1,CO2转化率为
(2)反应②的焓变△H
(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有
A、缩小反应器体积 B、加入水蒸气 C、升高温度到900℃D、使用合适的催化剂
(4)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度
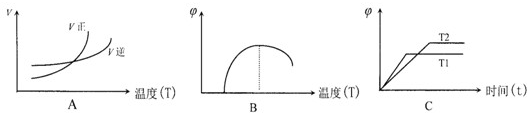
(5)下列图象符合反应①的是
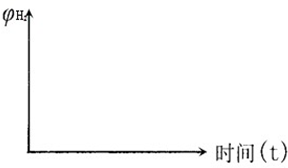
(6)根据题中表格数据,画出反应②在不同温度下的图象
 FeO(s)+CO(g) 平衡常数为K1;
FeO(s)+CO(g) 平衡常数为K1;反应②Fe(s)+H2O(g)
 FeO(s)+H2(g) 平衡常数为K2
FeO(s)+H2(g) 平衡常数为K2测得在不同温度下,K1、K2值如下:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |
50%
50%
.(2)反应②的焓变△H
小于
小于
0(填大于、小于、等于).(3)700℃反应②达到平衡,使得该平衡向右移动,其它条件不变时,可以采取的措施有
B
B
(填序号)A、缩小反应器体积 B、加入水蒸气 C、升高温度到900℃D、使用合适的催化剂
(4)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度
增大
增大
;②再通入CO2,CO2的转化率不变
不变
.(5)下列图象符合反应①的是
A
A
(填序号)(图中v是速率、?为混合其中CO含量,T为温度)
(6)根据题中表格数据,画出反应②在不同温度下的图象

分析:(1)根据平衡常数计算;
(2)由表中数据可知,温度越高平衡常数K2越小,所以平衡向逆反应进行,升高温度平衡向吸热方向移动,由此判断;
(3)反应②反应前后气体体积不变,压强、催化剂不能使平衡移动,可通过改变温度、浓度使平衡向正反应移动;
(4)①由表中数据可知,温度越高平衡常数K1越大,所以平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,据此解答;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变;
(5)反应①反应前后气体体积不变,正反应为吸热反应,据此分析判断;
(6)反应②温度越高,平衡常数K2越小,所以平衡向逆反应进行,平衡时氢气的体积分数减小,温度越高反应速率越快,到达平衡时间越短,据此作图.
(2)由表中数据可知,温度越高平衡常数K2越小,所以平衡向逆反应进行,升高温度平衡向吸热方向移动,由此判断;
(3)反应②反应前后气体体积不变,压强、催化剂不能使平衡移动,可通过改变温度、浓度使平衡向正反应移动;
(4)①由表中数据可知,温度越高平衡常数K1越大,所以平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,据此解答;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变;
(5)反应①反应前后气体体积不变,正反应为吸热反应,据此分析判断;
(6)反应②温度越高,平衡常数K2越小,所以平衡向逆反应进行,平衡时氢气的体积分数减小,温度越高反应速率越快,到达平衡时间越短,据此作图.
解答:解:(1)反应①Fe(s)+CO2(g)  FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)
FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)
×2mol.L-1=1mol.L-1,
所以CO2转化率为
×100%=50%,故答案为:50%;
(2)由表中数据可知,温度越高反应②平衡常数K2越小,所以平衡向逆反应进行,升高温度平衡向吸热方向移动,所以反应②正反应为放热反应,即△H<0,
故答案为:小于;
(3)由(2)分析知反应②正反应为放热反应,且反应前后气体体积不变.
A、缩小反应器体积,增大压强,平衡不移动,故A错误;
B、加入水蒸气,反应物的浓度增加,平衡向正反应移动,故B正确;
C、该反应为放热反应,升高温度平衡向逆反应进行,故C错误;
D、使用合适的催化剂,缩短到达平衡时间,平衡不移动.故D错误.
故选:B;
(4)①由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,CO2的平衡浓度增大,故答案为:增大;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变,故答案为:不变;
(5)由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,且反应①反应前后气体体积不变.
A、处于交点时,正逆速率相等,反应处于平衡状态,当温度高于交点温度,平衡向正反应移动,说明图象表示正反应为吸热反应,符合温度变化对反应①的影响,故A正确;
B、在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图象表示正反应为放热反应,故B错误;
C、到达平衡时间越短,速率越快,温度越高,所以T1>T2,温度越高,CO的含量越低,平衡向逆反应移动,说明图象表示正反应为放热反应,故C错误.
故选:A;
(6)反应②温度越高,平衡常数K2越小,所以平衡向逆反应进行,平衡时氢气的体积分数减小.温度越高反应速率越快,到达平衡时间越短.所以反应②在不同温度下的图象为:
 ,故答案为:
,故答案为: .
.
 FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)
FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)| 1 |
| 2 |
所以CO2转化率为
| 2mol/L-1mol/L |
| 2mol/L |
(2)由表中数据可知,温度越高反应②平衡常数K2越小,所以平衡向逆反应进行,升高温度平衡向吸热方向移动,所以反应②正反应为放热反应,即△H<0,
故答案为:小于;
(3)由(2)分析知反应②正反应为放热反应,且反应前后气体体积不变.
A、缩小反应器体积,增大压强,平衡不移动,故A错误;
B、加入水蒸气,反应物的浓度增加,平衡向正反应移动,故B正确;
C、该反应为放热反应,升高温度平衡向逆反应进行,故C错误;
D、使用合适的催化剂,缩短到达平衡时间,平衡不移动.故D错误.
故选:B;
(4)①由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,CO2的平衡浓度增大,故答案为:增大;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变,故答案为:不变;
(5)由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,且反应①反应前后气体体积不变.
A、处于交点时,正逆速率相等,反应处于平衡状态,当温度高于交点温度,平衡向正反应移动,说明图象表示正反应为吸热反应,符合温度变化对反应①的影响,故A正确;
B、在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图象表示正反应为放热反应,故B错误;
C、到达平衡时间越短,速率越快,温度越高,所以T1>T2,温度越高,CO的含量越低,平衡向逆反应移动,说明图象表示正反应为放热反应,故C错误.
故选:A;
(6)反应②温度越高,平衡常数K2越小,所以平衡向逆反应进行,平衡时氢气的体积分数减小.温度越高反应速率越快,到达平衡时间越短.所以反应②在不同温度下的图象为:
 ,故答案为:
,故答案为: .
.点评:本题考查化学平衡移动、平衡常数等问题,题目难度中等,作图注意含量与到达平衡时间.

练习册系列答案
相关题目