题目内容
【题目】(1)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):写出对应的化学方程式

① b ;
② c ;
③ e ;
(2)能证明氯水具有漂白性的现象是 ;
(3)久置的氯水变为 (填成份),用化学反应方程式表示为 。
(4)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
填写字母2KMnO4+16HCl(浓)=5Cl2↑+2MnCl2+2KCl+8H2O
①请用双线桥标出该反应的电子转移方向和数目 。
②该反应中的氧化剂是 ,若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是 。
【答案】(1)①2HCl+CaCO3=CaCl2+H2O+CO2↑(1分)
②HCl+AgNO3=AgCl↓+HNO3(1分)
③Cl2+2NaOH=NaCl+NaClO+H2O(1分)
(2)石蕊试液先变红后褪色;(1分)
(3)稀盐酸(1分);2HClO![]() 2HCl+O2↑(1分)
2HCl+O2↑(1分)
(4)① (2分)
(2分)
②高锰酸钾(1分)1mol(1分)
【解析】
试题分析::(1)①b发生盐酸与碳酸钙反应,反应的化学方程式为:2HCl+CaCO3=CaCl2+H2O+CO2↑;
②c是盐酸与硝酸银溶液反应,反应的化学方程式为:HCl+AgNO3=AgCl↓+HNO3;
③氯气与氢氧化钠发生反应,生成氯化钠和次氯酸钠,反应的离子方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯水中含有盐酸和次氯酸,盐酸能够使石蕊变红色,而次氯酸具有漂白性,能够使变红的石蕊褪色;
(3)次氯酸不稳定受热分解生成氯化氢和氧气,化学方程式为2HClO![]() 2HCl + O2↑,所以久置的氯水变为盐酸;
2HCl + O2↑,所以久置的氯水变为盐酸;
(4)①根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示: ;
;
②高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMnO4~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol。

 阅读快车系列答案
阅读快车系列答案【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如表。其中花卉根细胞吸收最少的离子是
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO4﹣ | SO42﹣ | Zn2+ |
培养液浓度 | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. Ca2+ B. SO42﹣ C. Zn2+ D. H2PO4﹣
【题目】某学习小组研究影响锌与稀硫酸反应速率的外界条件,设计实验的数据如下:
实验序号 | 锌的质量/g | 锌的状态 | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | 反应前溶液的温度/℃ | 其他试剂 |
1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
5 | 0.65 | 粉末 | 0.8 | 50 | 35 | 2滴CuSO4溶液 |
(1)在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过测定 进行判断,其速率最快的是 (填实验序号)。
(2)实验1和2表明 对反应速率有影响;实验1和3表明 对反应速率有影响。
(3)进行实验2时,小组同学根据实验过程绘制的氢气体积(标准状况下)与时间的关系如图所示。
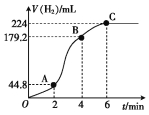
①在OA、AB、BC三段中反应速率最快的是 ,其原因是 。
②2~4 min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)v(H2SO4)= mol·L-1·min-1。

