题目内容
将过量的金属锌投入到含0.200 mol H2SO4的热浓硫酸中,下列判断正确的是 ( )
A.因发生“钝化”而不反应 B.产生的SO2为0.100 mol
C.产生的SO2少于0.100 mol D.除SO2外还会有H2产生
【答案】
CD
【解析】
试题分析:浓硫酸是氧化性酸,开始阶段锌和浓硫酸反应生成SO2,但随着反应的进行,硫酸的浓度逐渐降低,稀硫酸与锌反应生成的是氢气。根据反应式Zn+2H2SO4(浓)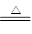 ZnSO4+2H2O+SO2↑可知,所以实际生成的氢气小于0.01mol,答案选CD。
ZnSO4+2H2O+SO2↑可知,所以实际生成的氢气小于0.01mol,答案选CD。
考点:考查锌与浓硫酸反应的有关判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,难易适中,贴近高考。该题的关键是明确稀硫酸与浓硫酸的性质差异,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力,提高学生灵活运用知识解决实际问题的能力。

练习册系列答案
相关题目