题目内容
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液_____NaHCO3溶液(填“>”、“<”或“=”)。
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=______。
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为___________(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是_____(填字母序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显_______性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
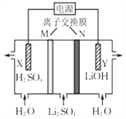
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
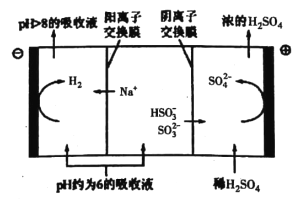
HSO3-在阳极放电的电极反应式是__________________。
【答案】 = 9 3HCO3﹣+Al3+=Al(OH)3↓+3CO2↑ c(CH3COO﹣)<c(NO2﹣)<c(NO3﹣) BC 酸性 HSO3-存在:HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度强于水解程度。 a b HSO3-+H2O-2e-= SO42-+3H+
H2SO3+OH-,HSO3-的电离程度强于水解程度。 a b HSO3-+H2O-2e-= SO42-+3H+
【解析】(1)①Na2CO3溶液中,存在CO32-水解:CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,NaHCO3溶液中存在:HCO3-+H2O
H2CO3+OH-,NaHCO3溶液中存在:HCO3-+H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() CO32-+H+,水溶液中均存在:H2O
CO32-+H+,水溶液中均存在:H2O![]() OH-+H+,所以Na2CO3溶液和NaHCO3溶液中的粒子种类相同。②25℃时CO32-第一步水解的平衡常数K1=
OH-+H+,所以Na2CO3溶液和NaHCO3溶液中的粒子种类相同。②25℃时CO32-第一步水解的平衡常数K1=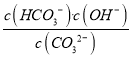 =2×10-4mol/L,溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=1×10-5mol/L,c(H+)=Kw/c(OH-)=1×10-9mol/L,所以溶液的pH=9。③NaHCO3溶液和Al2(SO4)3溶液混合时发生相互促进的水解,彻底反应生成Al(OH)3沉淀和CO2气体,离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑。
=2×10-4mol/L,溶液中c(HCO3-):c(CO32-)=20:1时,c(OH-)=1×10-5mol/L,c(H+)=Kw/c(OH-)=1×10-9mol/L,所以溶液的pH=9。③NaHCO3溶液和Al2(SO4)3溶液混合时发生相互促进的水解,彻底反应生成Al(OH)3沉淀和CO2气体,离子反应方程式为:3HCO3-+Al3+=Al(OH)3↓+3CO2↑。
(2)溶液A中NaNO3和NaNO2均为0.1mol/L,溶液B为0.1mol/LCH3COONa溶液,HNO3为强酸,HNO2和CH3COOH均为弱酸,由电离常数可知HNO2酸性强于CH3COOH,则钠盐溶液中CH3COO-水解程度大于NO2-水解程度,所以两份溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由小到大的顺序为:c(CH3COO-)<c(NO2-)<c(NO3-);由上述分析可知,溶液B的碱性强于溶液A的碱性,A项,向溶液A中加适量水,溶液A被稀释,A的碱性减弱,溶液A和溶液B的pH不会相等,故A错误;B项,向溶液A中加适量NaOH,A的碱性增强,可以使溶液A和溶液B的pH相等,故B正确;C项,向溶液B中加适量水,溶液B被稀释,B的碱性减弱,可以使溶液A和溶液B的pH相等,故C正确;D项,向溶液B中加适量NaOH,B的碱性增强,溶液A和溶液B
(3)①由表中数据可知,n(SO32-):n(HSO3-)=1:91时,溶液显酸性,故NaHSO3溶液显酸性,在亚硫酸氢钠溶液中HSO3-存在:HSO3-![]() H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O![]() H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液显酸性。②当吸收液呈中性时,溶液中c(H+)=c(OH-),根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确;由于n(SO32-):n(HSO3-)=91:9时,溶液的pH值为8.2,n(SO32-):n(HSO3-)=1:1时,溶液的pH值为7.2,所以中性时一定有c(HSO3-)>c(SO32-),弱离子的电离或水解是微弱的,可推出:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误。③阳极发生氧化反应,根据电解槽所示的变化可知,HSO3-在阳极放电生成SO42-和H+,故电极反应式为:HSO3-+H2O-2e-= SO42-+3H+。
H2SO3+OH-,HSO3-的电离程度强于水解程度,故溶液显酸性。②当吸收液呈中性时,溶液中c(H+)=c(OH-),根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),故a正确;由于n(SO32-):n(HSO3-)=91:9时,溶液的pH值为8.2,n(SO32-):n(HSO3-)=1:1时,溶液的pH值为7.2,所以中性时一定有c(HSO3-)>c(SO32-),弱离子的电离或水解是微弱的,可推出:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;根据电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误。③阳极发生氧化反应,根据电解槽所示的变化可知,HSO3-在阳极放电生成SO42-和H+,故电极反应式为:HSO3-+H2O-2e-= SO42-+3H+。

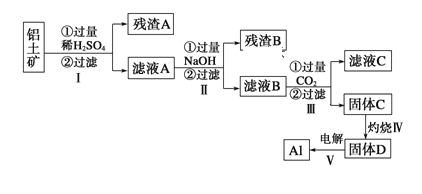
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

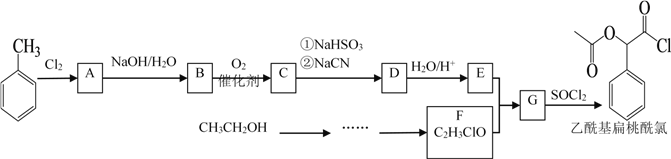
(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的1/3Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________________________。
当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性状 | 磁性大小 |
1:3 | 红棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为________________________。
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程Ⅰ的热化学方程式。
过程Ⅰ:________________________________,
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1
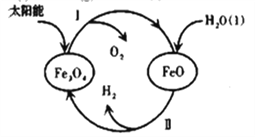
(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
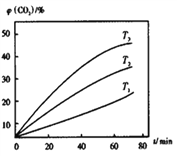
①T℃时,10min内用Fe3O4表示的平均反应速率为_____g·min-1。
②其他条件不变时,该反应在不同温度下,CO2含量随时间的变化φ(CO2)-t曲线如图所示,温度T1、T2、T3由大到小的关系是_________________,判断依据是___________________。