题目内容
【题目】乙酸是一种重要的有机酸,在工业合成和医学上有重要的用途。
回答下列问题:
(1)乙酸俗称______________。
(2)CH3COOH(I)、C(s)、H2(g)的燃烧热△H分别为-870.3kJ·mol-1、-393.5 kJ·mol-1、-285.8 kJ·mol-1,则反应2C(s)+2H2(g)+O2(g)=CH2COOH(I)的△H=______________。
(3)乙酸和乙酸钠按一定比例混合可制成治疗酸中毒或碱中毒的缓冲溶液。
①用离子方程表示该缓冲溶液能治疗碱中毒的原因:____________________________。
②常温下,体积为1L,浓度为0.1mol·L-1的乙酸电离度为1.3%,该温度下乙酸的电离平衡参数值为__________________(水的电离忽略不计,结果保留两位有效数字);向该溶液中加入_______molCH3COONa可使溶液的pH约为4(溶液体积变化忽略不计)。
(4)已知乙酸蒸气中存在乙酸二聚物,二者如下平衡:(CH3COOH)2(g)![]() 2CH3COOH(g) △H。
2CH3COOH(g) △H。
实验测定该平衡体系的![]() 随温度和压强的变化如图所示:
随温度和压强的变化如图所示:

①上述反应的△H_____(填“>”或“<”)0,a、b、c三点中平衡常数最大的点是______。
②测定乙酸的摩尔质量应选择的适宜条件是________________。
【答案】 醋酸 -488.3kJ·mol-1 CH3COOH+OH-=CH3COO-+H2O 1.7×10-3 1.7×10-5 > b 低压、高温
【解析】(1)乙酸俗称醋酸;
(2)25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1,
则H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1①,
O2(g)=H2O(l)△H=-285.8kJmol-1①,
C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,
由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热△H=2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1;
(3)①在乙酸和乙酸钠按一定比例混合可制成的缓冲溶液中,既存在醋酸的电离,又存在醋酸根离子的水解,当溶液中OH-浓度增大时,发生CH3COOH+OH-=CH3COO-+H2O,降低增加的OH-浓度,这就是该缓冲溶液能治疗碱中毒的原因;
②已知CH3COOH![]() CH3COO-+H+,Ka=
CH3COO-+H+,Ka= =
=![]() =1.7×10-5;设向该溶液中加入nmolCH3COONa可使溶液的pH约为4,此时c(H+)=10-4mol/L,c(CH3COO-)=n mol/L,c(CH3COOH)=0.1mol/L,温度不变,电离平衡常数不变,即
=1.7×10-5;设向该溶液中加入nmolCH3COONa可使溶液的pH约为4,此时c(H+)=10-4mol/L,c(CH3COO-)=n mol/L,c(CH3COOH)=0.1mol/L,温度不变,电离平衡常数不变,即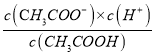 =1.7×10-5=
=1.7×10-5=![]() ,解得n=1.7×10-2mol;
,解得n=1.7×10-2mol;
(4)①由图示可知,温度升高![]() 减小,总物质的量增大,即平衡正向移动,△H>0,因升温平衡正向移动,反应限度越大,即b点平衡常数最大;
减小,总物质的量增大,即平衡正向移动,△H>0,因升温平衡正向移动,反应限度越大,即b点平衡常数最大;
②反应正方向为体积增大的方向,吸热反应,则由图示可知测定乙酸的摩尔质量应选择的适宜条件是低压、高温。