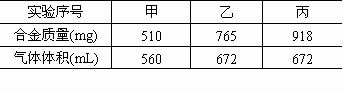
题目内容
在0℃和1.01×105Pa条件下,将0.1g氢气、3.2g二氧化硫、2.2g二氧化碳混合,该混合气体的体积是( )
| A、2.24L | B、4.48L | C、3.36L | D、6.72L |
分析:根据n=
计算各气体的物质的量,再根据V=nVm计算混合气体的体积.
| m |
| M |
解答:解:0.1g氢气的物质的量=
=0.05mol,
3.2g二氧化硫的物质的量=
=0.05mol,
2.2g二氧化碳的物质的量=
=0.05mol,
故标况下,混合气体的总体积=0.05mol×3×22.4L/mol=3.36L,
故选C.
| 0.1g |
| 2g/mol |
3.2g二氧化硫的物质的量=
| 3.2g |
| 64g/mol |
2.2g二氧化碳的物质的量=
| 2.2g |
| 44g/mol |
故标况下,混合气体的总体积=0.05mol×3×22.4L/mol=3.36L,
故选C.
点评:本题考查物质的量、气体摩尔体积的有关计算,比较基础,注意气体摩尔体积适用于单一气体和混合气体.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目