题目内容
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol·L-1的H2SO4溶液中,乙同学将电极放入6mol·L-1的NaOH溶液中,如图所示。
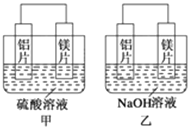
(1)甲中SO42-移向________极(填“铝片”或“镁片”)。写出甲中负极的电极反应式____________。
(2)乙中负极为________,总反应的离子方程式:_______________。此反应中氧化剂和还原剂的物质的量之比为________,还原产物是________。
(3)原电池是把______________的装置。上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案________(如可靠,此空可不填)。
【答案】 镁片 Mg-2e-=Mg2+ 铝片 2Al+2OH-+2H2O=2AlO2-+3H2↑ 3:1 H2 化学能转化为电能 不可靠 可以根据电流方向判断电池的正负极(或其它合理方案)
【解析】甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,据此解答。
(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应式为Mg-2e-=Mg2+;原电池中阴离子向负极移动,即硫酸根离子移向镁电极;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,总反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;由于得到电子的是水电离出的氢离子,根据电子得失守恒可知此反应中氧化剂和还原剂的物质的量之比为3:1,还原产物是H2;
(3)原电池是把化学能转化为电能的装置。上述实验说明,“直接利用金属活动性顺序表判断电池中的正负极”并不考可靠,最好是接一个电流计,通过观察电流方向判断原电池的正负极。

