题目内容
【题目】第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有__________种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是_______(填序号)。
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
(3)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。镓的基态原子的电子排布式是______________________________________。
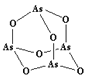
(4)稼氮砷合金材料的太阳能电池效率达40%,Ga、N、As电负性由大至小的顺序是________。As4O6的分子结构如下图所示,其中As原子的杂化方式为_______。
(5)已知:Fe(CO)5中Fe元素为0价,在一定条件下发生分解反应Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是__________。
【答案】 3 C 1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) N>As>Ga sp3 金属键
【解析】(1)第四周期元素中,基态原子的最外层只有1个电子的元素有K、Cr、Cu元素,故答案为:3;
(2)铂丝蘸取氯化钙在酒精灯上灼烧时,钙离子吸收能量而发生电子跃迁,所以火焰呈现砖红色,故选C;
(3)镓的基态原子的电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(4)稼氮砷合金材料的太阳能电池效率达40%,根据三种元素在周期表中的位置关系,Ga、N、As电负性由大至小的顺序为N>As>Ga。根据As4O6的分子结构示意图,As原子与三个O原子相连,含有一个孤电子对,采用sp3杂化,故答案为:N>As>Ga;sp3;
(5)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,所以形成的化学键为金属键,故答案为:金属键。