题目内容
2014年5月7日南京某建设公司丢失用于材料探伤的放射源Ir—192(铱—192)一枚,经相关部门的努力追查,丢失的放射源于5月10日被回收,Ir—192的放射性会对人体产生很大的伤害。已知Ir元素位于周期表中第6周期第Ⅷ族,原子序数为77,192为该核素的质量数,下列关于Ir—192的说法正确的是( )
| A.Ir—192核外含有115个电子 | B.Ir为非金属元素 |
| C.Ir—192中子数与质子数的差为38 | D.Ir元素与碘元素位于同一周期 |
C
解析试题分析:A、Ir元素原子序数为77,Ir—192核外含有77个电子,错误;B、Ir元素位于周期表中第6周期第Ⅷ族,属于过渡元素,过渡元素均为金属元素,错误;C、Ir—192中子数为115,质子数为77,中子数与质子数的差为38 ,正确;D、Ir元素位于周期表中第6周期,碘元素位于周期表中第5周期,不是同一周期,错误。
考点:考查原子的构成。

 阅读快车系列答案
阅读快车系列答案下列微粒中: ①13Al3+,②  ,③
,③  ,④F-,其核外电子数相同的是
,④F-,其核外电子数相同的是
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
下列叙述中正确的是
| A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高 |
| B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多 |
| C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB |
下列中各组性质的比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②离子还原性:S2->Cl->Br ->I- ③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->Na+>Na>Cl
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤⑥ |
卤素间形成的化合物如“IF5、BrCl、IBr”等称为卤素互化物,化学性质与卤素单质类似,则下列关于卤素互化物的性质的描述及发生的相关反应不正确的是( )
| A.IF5 + 3H2O = HIO3 +5HF |
| B.3IBr +2Fe = FeI3 + FeBr3 |
| C.BrCl的氧化性强于I2 |
| D.IBr可以与NaOH溶液反应生成2种盐 |
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 ( )
| A.原子半径: 丁 >丙>乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲,乙,丙的氧化物均为共价化和物 |
| D.乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是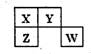
| A.Z元素的氧化物对应水化物的酸性一定弱于W |
| B.四种元素中Z的原子半径和形成的离子半径均最大 |
| C.X、Z、W中最简单气态氢化物稳定性最弱的是Z |
| D.X、Y、Z的原子均能与氢原子形成四原子分子 |
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
| A.原子半径:丙<丁<乙 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
