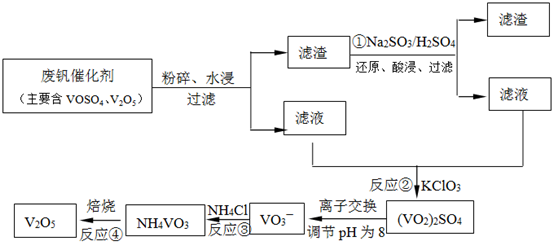
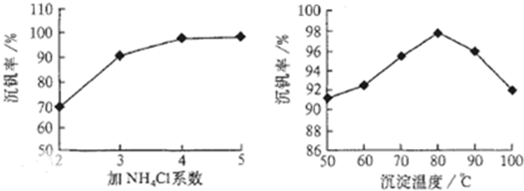
题目内容
下列反应不属于氧化还原反应的是( )
分析:有电子转移的化学反应是氧化还原反应,其特征是反应前后有元素化合价的变化.
解答:解:A.该反应中,双氧水中的氧元素部分得电子化合价降低,部分失电子化合价升高,所以是氧化还原反应,故A不选;
B.该反应中,各元素的化合价都不发生变化,所以不是氧化还原反应,故B选;
C.该反应中,氯元素得电子化合价降低,碳元素失电子化合价升高,所以该反应是氧化还原反应,故C不选;
D.该反应中,铜元素失电子,氧元素得电子,所以是氧化还原反应,故D不选;
故选B.
B.该反应中,各元素的化合价都不发生变化,所以不是氧化还原反应,故B选;
C.该反应中,氯元素得电子化合价降低,碳元素失电子化合价升高,所以该反应是氧化还原反应,故C不选;
D.该反应中,铜元素失电子,氧元素得电子,所以是氧化还原反应,故D不选;
故选B.
点评:本题考查了氧化还原反应的判断,根据元素化合价是否变化来分析判断即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2=Cu2S+2FeS+S…①2Cu2S+3O2=2Cu2O+2SO2…②
Cu2O+FeS=Cu2S+FeO③2FeS+3O2+SiO2=2FeO?SiO2+2SO2…④
2FeO+SiO2=2FeO?SiO2⑤Cu2S+2Cu2O=6Cu+SO2 ⑥
下列有关说法不正确的是( )
2CuFeS2=Cu2S+2FeS+S…①2Cu2S+3O2=2Cu2O+2SO2…②
Cu2O+FeS=Cu2S+FeO③2FeS+3O2+SiO2=2FeO?SiO2+2SO2…④
2FeO+SiO2=2FeO?SiO2⑤Cu2S+2Cu2O=6Cu+SO2 ⑥
下列有关说法不正确的是( )
| A、上述反应均属于氧化还原反应 | B、该厂可同时建硫酸厂和炼铁厂 | C、该厂的原料除富铜矿外,还需空气和硅石 | D、反应④转移12e- |
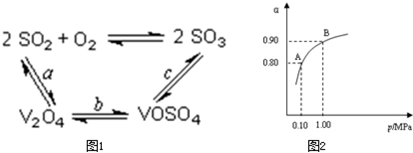
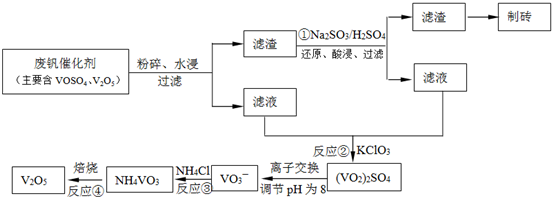
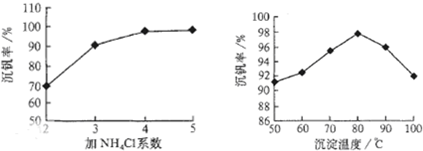
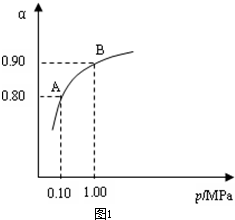 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: