题目内容
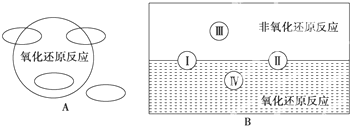
(1)①A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO═Cu+H2O所属的区域是______.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为______反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:______.写出有水参加的符合反应类型Ⅳ的一个化学方程式:______,其中水为______剂.
(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有______(填序号,下同);H2O被氧化的是______,H2O被还原的是______,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是______.
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由______价变为______价,被______;______元素的原子失去电子,被______;若参加反应的HCl是73g,则被氧化的HCl是______g.
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是______
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
②“四种基本反应类型与氧化还原反应的关系”也可用B图表达.其中Ⅰ为化合反应,则Ⅱ为______反应.写出有水生成的符合反应类型Ⅲ的一个化学方程式:______.写出有水参加的符合反应类型Ⅳ的一个化学方程式:______,其中水为______剂.

(2)已知反应:①SO3+H2O═H2SO4
②Cl2+H2O═HCl+HClO
③2F2+2H2O═4HF+O2
④2Na+2H2O═2NaOH+H2↑
⑤2Na2O2+2H2O═4NaOH+O2↑
⑥SiO2+2NaOH═Na2SiO3+H2O
上述反应中不属于氧化还原反应的有______(填序号,下同);H2O被氧化的是______,H2O被还原的是______,属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是______.
(3)反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,
Mn元素的化合价由______价变为______价,被______;______元素的原子失去电子,被______;若参加反应的HCl是73g,则被氧化的HCl是______g.
(4)根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是______
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2.
(1)①H2+CuO═Cu+H2O中铜和氢元素的化合价发生变化,所以是氧化还原反应,同时又是置换反应,所以在图A中的图象为:

,故答案为:

;
②II为分解反应,III是非氧化还原反应,反应中没有元素化合价的变化,如酸碱中和反应,反应方程式为:NaOH+HCl═NaCl+H2O,有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑,该反应的水中氢元素得电子,所以水是氧化剂,
故答案为:分解;NaOH+HCl═NaCl+H2O;2Na+2H2O═2NaOH+H2↑;氧化;
(2)①SO3+H2O═H2SO4中各元素的化合价都不变化,所以不是氧化还原反应;
②Cl2+H2O═HCl+HClO中氯气既是氧化剂又是还原剂,水中各元素的化合价不变,所以水既不是氧化剂又不是还原剂;
③2F2+2H2O═4HF+O2中氟气作氧化剂,水作还原剂;
④2Na+2H2O═2NaOH+H2↑中钠是还原剂,水是氧化剂;
⑤2Na2O2+2H2O═4NaOH+O2↑中过氧化钠是氧化剂又是还原剂,水水既不是氧化剂又不是还原剂;
⑥SiO2+2NaOH═Na2SiO3+H2O中各元素的化合价不变,所以不是氧化还原反应;
故答案为:①⑥;③;④;②⑤;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,锰元素由+7价得电子变为+2价,在反应中被还原,氯化氢中氯元素失电子,所以氯化氢作还原剂,被氧化,该反应中如果有2mol高锰酸钾参加氧化还原反应,则有10mol盐酸被氧化,参加反应的盐酸的物质的量是16mol,即参加反应的
=
的盐酸参加氧化还原反应,所以若参加反应的HCl是73g,则被氧化的HCl是45.625g,
故答案为:+7;+2;还原;Cl;氧化;45.625;
(4)①2FeCl3+2KI═2FeCl2+2KCl+I2中氧化性Fe3+>I2,②2FeCl2+Cl2=2FeCl3中氧化性Cl2>Fe3+,所以三种微粒的氧化性由强到弱的顺序是Cl2>Fe3+>I2,故选D.

,故答案为:

;
②II为分解反应,III是非氧化还原反应,反应中没有元素化合价的变化,如酸碱中和反应,反应方程式为:NaOH+HCl═NaCl+H2O,有水参加的符合反应类型Ⅳ的一个化学方程式:2Na+2H2O═2NaOH+H2↑,该反应的水中氢元素得电子,所以水是氧化剂,
故答案为:分解;NaOH+HCl═NaCl+H2O;2Na+2H2O═2NaOH+H2↑;氧化;
(2)①SO3+H2O═H2SO4中各元素的化合价都不变化,所以不是氧化还原反应;
②Cl2+H2O═HCl+HClO中氯气既是氧化剂又是还原剂,水中各元素的化合价不变,所以水既不是氧化剂又不是还原剂;
③2F2+2H2O═4HF+O2中氟气作氧化剂,水作还原剂;
④2Na+2H2O═2NaOH+H2↑中钠是还原剂,水是氧化剂;
⑤2Na2O2+2H2O═4NaOH+O2↑中过氧化钠是氧化剂又是还原剂,水水既不是氧化剂又不是还原剂;
⑥SiO2+2NaOH═Na2SiO3+H2O中各元素的化合价不变,所以不是氧化还原反应;
故答案为:①⑥;③;④;②⑤;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,锰元素由+7价得电子变为+2价,在反应中被还原,氯化氢中氯元素失电子,所以氯化氢作还原剂,被氧化,该反应中如果有2mol高锰酸钾参加氧化还原反应,则有10mol盐酸被氧化,参加反应的盐酸的物质的量是16mol,即参加反应的
| 10 |
| 16 |
| 5 |
| 8 |
故答案为:+7;+2;还原;Cl;氧化;45.625;
(4)①2FeCl3+2KI═2FeCl2+2KCl+I2中氧化性Fe3+>I2,②2FeCl2+Cl2=2FeCl3中氧化性Cl2>Fe3+,所以三种微粒的氧化性由强到弱的顺序是Cl2>Fe3+>I2,故选D.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目




