题目内容
若按图甲装置进行实验,图乙中x、y分别表示流入电极的电子、某产物的物质的量。若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液,电解过程中溶液的pH随时间t变化的示意图如丙所示。则下列叙述中正确的是( )


| A.E表示反应生成Cu的物质的量 |
| B.F表示反应生成H2SO4的物质的量 |
| C.BC段阳极产物是Cl2 |
| D.CD段电解的物质是水 |
BD
甲装置为电解装置,电解硫酸铜的电极反应式分别为:C(阳极)4OH——4e—=O2+2H2O;
Cu(阴极)2Cu2++4e—= 2Cu;总反应方程式为: 2CuSO4+2H2O===2Cu+ O2+2H2SO4;
即A错,E表示反应生成H+的物质的量;B正确,F表示反应生成H2SO4的物质的量;
若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液即相当于溶液存在等物质的量的CuSO4和NaCl,电解时,第一阶段AB段为电解CuCl2(溶液中铜离子浓度减少,溶液的PH增大),第二阶段为BC段电解CuSO4(溶液中氢离子浓度增大,PH减小),阳极为氢氧根离子放电,产物为O2;第三阶段为CD段电解水(溶液中氢离子浓度增大,PH再减小);
即C错,D正确;
Cu(阴极)2Cu2++4e—= 2Cu;总反应方程式为: 2CuSO4+2H2O===2Cu+ O2+2H2SO4;
即A错,E表示反应生成H+的物质的量;B正确,F表示反应生成H2SO4的物质的量;
若将甲装置中的溶液改为等体积、等物质的量浓度的CuSO4和NaCl溶液的混合液即相当于溶液存在等物质的量的CuSO4和NaCl,电解时,第一阶段AB段为电解CuCl2(溶液中铜离子浓度减少,溶液的PH增大),第二阶段为BC段电解CuSO4(溶液中氢离子浓度增大,PH减小),阳极为氢氧根离子放电,产物为O2;第三阶段为CD段电解水(溶液中氢离子浓度增大,PH再减小);
即C错,D正确;

练习册系列答案
相关题目

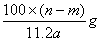
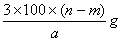
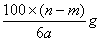
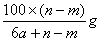
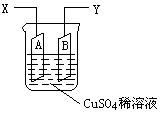
 6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质
6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质 mol/L。
mol/L。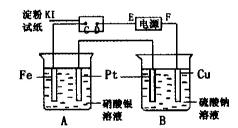
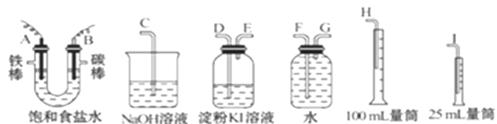
 _______
_______  ______,
______,