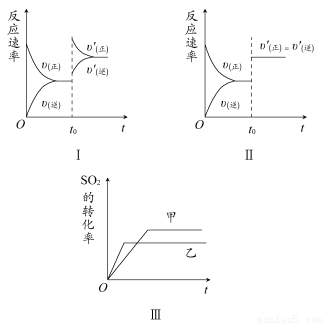
题目内容
加0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g· mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
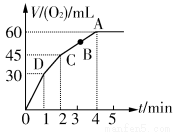
(1)实验时放出气体的总体积是_____________________________。
(2)放出一半气体所需时间为_______________________________。
(3)反应放出气体总体积的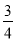 所需的时间约为__________________
所需的时间约为__________________
(4)A、B、C、D各点反应速率快慢的顺序为____________________
(5)解释反应速率变化的原因___________________________________________________
(6)计算H2O2的初始物质的量浓度____________________
(7)求反应到2 min时,H2O2的质量分数_________________________
(1)60 mL (2)1 min (3)2 min (4)D>C>B>A
(5)随着反应的进行,c(H2O2)逐渐降低,反应逐渐变慢
(6)0.107 mol·L-1 (7)0.084%
【解析】根据V-t图像知,反应进行至1 min时,放出O2的体积为30 mL,反应进行至2 min时,放出O2 45 mL,反应进行至4 min,放出O2的体积达最大值60 mL;由V-t曲线的斜率变化可知:D、C、B、A的反应速率逐渐减小,这是因为随着反应的进行,c(H2O2)逐渐降低,反应逐渐变慢;根据2H2O2  2H2O+O2↑,n(H2O2)=
2H2O+O2↑,n(H2O2)= 
 ×2,所以H2O2的起始物质的量浓度为:
×2,所以H2O2的起始物质的量浓度为: 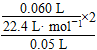 =0.107 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为
=0.107 mol·L-1;反应进行至2 min时,消耗H2O2的物质的量为 ×2=0.004 mol,剩余H2O2的物质的量为
×2=0.004 mol,剩余H2O2的物质的量为 ×2-0.004 mol=1.36×10-3 mol。
×2-0.004 mol=1.36×10-3 mol。
所以w(H2O2)= ×100%≈0.084%。
×100%≈0.084%。

甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
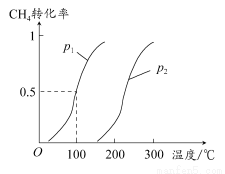
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
ⅰ | 150 | ? | 0.1 |
ⅱ | ________ | ________ | 5 |
ⅲ | 350 | ________ | 5 |