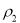题目内容
| A.C4H8 | B.C3H4 | C.C2H6 | D.C2H4 |
A,C4H8需要消耗氧气量是该烃量的6倍,故A正确;
B、C3H4需要消耗氧气量是该烃量的4倍,故B错误;
C、C2H6需要消耗氧气量是该烃量的3.5倍,故C错误;
D、C2H4需要消耗氧气量是该烃量的3倍,故D错误.
故选:A.

 阅读快车系列答案
阅读快车系列答案下列图片中的资料对应的说法正确的是
| A | B | C | D |
资料 |
聚乙烯可做 包装材料 |
分类收集垃圾有利于资源的回收利用 |
水果、蔬菜、肉类都含重要的营养物质 |
服用补铁剂同时服用Vc片 |
说法 | 无毒,用于食品、药品包装 | 废旧手机电池放入此标志的垃圾桶 | 柠檬是酸性食品,肉类是碱性食品
| 利用Vc酸性OTC表示非处方药 |
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
达到平衡的时间/min |
| 6 | 8 |
平衡时 N2的体积密度 | C1 | 1.5 |
|
混合气体密度/g·L-1 |
|
|
|
平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.氮气的转化率:
b.氮气的转化率: c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。