题目内容
【题目】①已知t ℃时AgCl的Ksp=2.0×10-10;②在t ℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
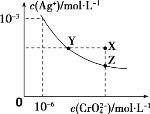
A. 在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B. 在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C. 在t ℃时,以0.01 mol·L-1AgNO3溶液滴定20.00 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液,CrO42-后沉淀
D. 在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO
2AgCl(s)+CrO![]() (aq)的平衡常数K=2.5×107
(aq)的平衡常数K=2.5×107
【答案】B
【解析】
A、依据图象曲线上的数据结合溶度积常数概念计算得到,曲线上的点是沉淀溶解平衡。Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4 (s)![]() 2Ag+ +CrO42-,Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,故A正确;
2Ag+ +CrO42-,Ksp=c2(Ag+)·c(CrO42-)=(10-3)2×10-6=10-12,故A正确;
B、在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故B错误;
C、依据溶度积常数计算Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01mol/L AgNO3溶液滴定20mL0.01mol/L KCl和0.01mol/L的K2CrO4的混合溶液,c(CrO42-)=0.01mol/L,得到c(Ag+)=![]() =10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=
=10-5mol/L,0.01mol/L KCl溶液中,c(Cl-)=0.01mol/L;依据溶度积计算得到:c(Ag+)=![]() =2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
=2×10-8mol/L,所以先析出氯化银沉淀,故C正确;
D、K=![]() =
=![]() =
=![]() =2.5×107,故D正确。
=2.5×107,故D正确。
答案选B。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|