题目内容
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A.标准状况下,NA个NO分子和0.5 NA个O2分子混合后气体的总体积为33.6 L |
| B.10g D2O晶体中含有的氢氧键数目为NA |
| C.标准状况下,1 mol SO3分子体积约为22.4 L |
| D.常温常压下,1 mol氦气含有的核外电子数为4 NA |
B
试题分析:A项:NO与O2恰好发生反应2NO+O2=2NO2所以体积不等于33.6L,错误;B项:10g D2O的物质的量为1mol,氢氧键数目为NA,正确;C项:标准状况下SO3为固体,所以错误;D项:氦气为单原子分子,所以1mol所含的核外电子数为2NA,错误。

练习册系列答案
相关题目
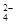 ,SO
,SO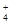 含有电子数为10NA
含有电子数为10NA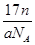
 mol
mol