��Ŀ����
����Ŀ��ijʵ��С��������ͼ����װ�ý��С�����ˮ������Ӧ����ʵ�飬�����ò����һ����ȡFeCl36H2O���壮��ͼ�мгּ�β������װ�þ�����ȥ����ش��������⣺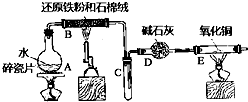
��1��װ��B�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��2��E�г��ֵ������� ��
��3����С���B�з�Ӧ��IJ���������������ᣬ�ø���Һ��ȡFeCl36H2O���壮
����������Һ�к���Fe3+ �� ѡ�õ��Լ�Ϊ �� ������ ��
�ڸ�ʵ��С��ͬѧ�������Լ�û�м�Fe3+ �� �����ӷ���ʽ������Һ�в�����Fe3+���ܵ�ԭ�� ��
�۽�����Һ��FeCl2��ȫ����ΪFeCl3���ѡ�����������е� ��
A������KMnO4��Һ B��Cl2 C��Na2O2 D��FeCl3
���ڢ�������ҺŨ���ᾧǰ��Ҫ��ʵ��֤��FeCl2����ȫ������ʵ�鷽���� ��
���𰸡�
��1��3Fe+4H2O ![]() Fe3O4+4H2
Fe3O4+4H2
��2����ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ��
��3��KSCN��Һ������Һ��μ�KSCN��Һ����Һ��Ѫ��ɫ��Fe+2Fe3+=3Fe2+��B����С�Թ�ȡ�â۷�Ӧ�����Һ1��2ml�����뼸�����Ը��������Һ����Һ����ɫ��֤���Ȼ������ѱ�ȫ������
���������⣺��1��Fe��ˮ������Ӧ����Fe3O4��H2 �� ��Ӧ�Ļ�ѧ����ʽ��3Fe+4H2O ![]() Fe3O4+4H2 ��
Fe3O4+4H2 ��
���Դ��ǣ�3Fe+4H2O ![]() Fe3O4+4H2����2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E������ͭ���������ȷ�����Ӧ������ͭ��ˮ�����Է�Ӧ������Ϊ����ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�飬
Fe3O4+4H2����2��װ��B����ˮ������Ӧ���ɵ�����������ʯ�Ҹ�������װ��E������ͭ���������ȷ�����Ӧ������ͭ��ˮ�����Է�Ӧ������Ϊ����ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�飬
���Դ��ǣ���ɫ�ķ�ĩ����Ϻ�ɫ���ܱڲ���ˮ�飻��3����Fe3+�ļ��鷽���ǣ�ȡ������Һ�����뼸�����軯����Һ���۲���Һ�Ƿ���ɫ��
���Դ��ǣ�KSCN��Һ������Һ��μ�KSCN��Һ����Һ��Ѫ��ɫ��������ϵ�м������ۣ�������۲��ܽ⣬˵��������Fe3+ �� �������ӷ�Ӧ����ʽΪ��Fe+2Fe3+=3Fe2+ ��
���Դ��ǣ�Fe+2Fe3+=3Fe2+������Һ��FeCl2��ȫ����ΪFeCl3 ��
A������KMnO4��Һ �������Ȼ�����������������ӡ������ӵȣ���A����
B��Cl2 �����Ȼ�����Ϊ�Ȼ������������µ����ʣ���B��ȷ��
C��Na2O2 ��ˮ��Ӧ�����������ƣ������������Ӻ������ӣ����ܳ�ȥ����C����
D��FeCl3 ���������Ȼ���������D����
���Դ��ǣ�B�����ڢ�������ҺŨ���ᾧǰ��Ҫ��ʵ��֤��FeCl2����ȫ������ʵ�鷽���ǣ���С�Թ�ȡ�â۷�Ӧ�����Һ1��2ml�����뼸�����Ը��������Һ����Һ����ɫ��֤���Ȼ������ѱ�ȫ��������
���Դ��ǣ���С�Թ�ȡ�â۷�Ӧ�����Һ1��2ml�����뼸�����Ը��������Һ����Һ����ɫ��֤���Ȼ������ѱ�ȫ��������

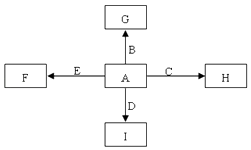
����Ŀ����ͼ��ʾϸ����ijЩ�л����Ԫ����ɺ��ܹ�ϵ������a��b����Ԫ�أ������������ӣ�X��Y��Z��P�ֱ�Ϊ�����������ӵĻ�����λ����ش��������⣺

��1��ͼ��A��__________________________��
��2��ͼ��X��_____________________������С����������Ҫ��ָ______________________��
��3��ͼ��Z��____________��ʹ�ü��̡����������Ⱦɫ��Ⱦɫ����ʹ�����__________ɫ��
��4��ͼ��P�ĽṹͨʽΪ__________________�����γɢ��ķ�ʽ��_________�����ڽṹ�Ͼ��ж����ԣ����������______________________��
��5���õ�Һ���յ���ȾҺ��˫�����Լ���üס��ҡ�������ֲ��ĸ��������������л�����ɫ��Ӧ���±������С�+��������������ɫ��Ӧ��dz�̶ȣ������й�˵������ȷ���� ��____��
�Լ����� | ��Һ | �յ���ȾҺ | ˫�����Լ� |
�� | + + + + | + + | + |
�� | + + | + + + + | + + |
�� | + | + + | + + + + |
A.����������Ҫ��������
B.��Һ���յ���ȾҺ��˫�����Լ�����Ӧ�����ʷ�������ɫ��Ӧ�ֱ�����ɫ���ٻ�ɫ����ɫ
C.�ڹ۲���ɫʱ�п����õ���ѧ����
D.�������Լ�ʹ�þ�����Ҫˮԡ����