题目内容
把锌片和铁片放在盛有稀食盐水和酚酞混合液的表面皿中,如图所示,最先观察到酚酞变红现象的区域是( )

分析:左边表面皿是电解池,铁作阳极,锌作阴极,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应;
右边表面皿是原电池,锌作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氧气得电子发生还原反应.
右边表面皿是原电池,锌作负极,铁作正极,负极上锌失电子发生氧化反应,正极上氧气得电子发生还原反应.
解答:解:左边表面皿是电解池,铁作阳极,锌作阴极,阳极上铁失电子发生氧化反应生成亚铁离子,阴极上氢离子得电子发生还原反应生成氢气,同时还有氢氧根离子生成,所以II使酚酞试液变红;
右边表面皿是原电池,锌作负极,铁作正极,负极上锌失电子生成锌离子而发生氧化反应,正极上氧气得电子生成氢氧根离子而发生还原反应,所以III处使酚酞试液变红,
故选C.
右边表面皿是原电池,锌作负极,铁作正极,负极上锌失电子生成锌离子而发生氧化反应,正极上氧气得电子生成氢氧根离子而发生还原反应,所以III处使酚酞试液变红,
故选C.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,注意活泼金属作阳极上,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图所示。
最先观察到酚酞变红的现象的区域是
| A.I和III | B.I和IV |
| C.II和III | D.II和IV |
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,两个实验中,首先观察到溶液变红的区域是( )
| A.Ⅰ和Ⅲ附近 | B.Ⅰ和Ⅳ附近 | C.Ⅱ和Ⅲ附近 | D.Ⅱ和Ⅳ附近 |
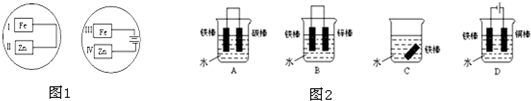
 把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是( )