题目内容
【题目】Ⅰ.如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两装置中均为CuSO4溶液,反应一段时间后:
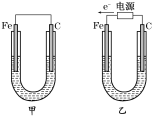
①有红色物质析出的分别是甲、乙装置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙装置中阳极的电极反应式是:____________________________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_________________________________________。
②将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:___________。
Ⅱ.如图为绿色电源“甲烷燃料电池”的工作原理示意图。
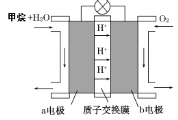
负极的电极反应为______________________
【答案】 B 4OH--4e-=2H2O+O2↑ 2Cl-+2H2O ![]() Cl2↑+H2↑+2OH- 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 CH4-8e-+2H2O==CO2+8H+
Cl2↑+H2↑+2OH- 在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝 CH4-8e-+2H2O==CO2+8H+
【解析】本题考查原电池、电解池和燃料电池的相关知识。解答时抓住原电池和电解池的工作原理进行判断。(1)活泼金属做负极,电子是由负极经导线流向正极。(2)在电解池中是阳极与正极相连,阴极与负极相连。根据放电顺序进行判断。(3)燃料电池是燃料做负极,氧气做正极。
Ⅰ(1)①甲为原电池,Fe为负极,碳棒做正极,发生的电极反应为Cu2++2 e-= Cu,所以碳电极上生成红色物质Cu,乙为电解池,根据电子流向知Fe为阴,电极反应为Cu2++2 e-= Cu,所以答案为:B。
②乙为电解池,由电子流向可知,Fe为阴极,铜离子得到电子生成Cu,碳棒做阳极,氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:4OH--4e-=O2↑+2H2O;
(2)①乙为电解池,电解NaCl溶液生成NaOH、氢气、氯气,所以离子反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
②碳电极为阳极,阳极上生成氯气,氯气和碘离子发生置换反应生成碘,碘遇淀粉试液变蓝色,答案:在乙装置碳棒电极上生成Cl2,Cl2与I-反应生成I2,I2遇淀粉变蓝。
Ⅱ为甲烷燃料电池,燃料做负极,氧气做正极。根据甲烷燃料燃烧知在酸性介质中负极的电极反应方程式为:CH4-8e-+2H2O=CO2+8H+。答案:CH4-8e-+2H2O=CO2+8H+。

【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(1)该反应的平衡常数表达式K= .
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.
实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL 18molL﹣1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:
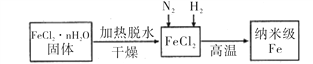
(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。


