题目内容
下列反应中有关电子转移的数目分析正确的是
- A.某密闭容器盛有2mol N2和6mol H2,在一定条件下充分反应,转移电子的数目为12NA
- B.标准状况下,1mol Cl2溶于水,转移的电子数目为NA
- C.50mL 18.4mol/L浓硫酸与足量铜微热反应生成SO2,转移的电子数目为0.92NA
- D.一定条件下,4.6g的Na完全与O2反应生成7.2g产物时失去的电子数目为0.2NA
D
A:发生的是可逆反应,不能进行到底;B:氯水中的氯气只部分溶于水;C:稀硫酸与铜不反应;故选D:不管产物如何, 4.6g的Na完全反应后必然失电子为0.2NA
A:发生的是可逆反应,不能进行到底;B:氯水中的氯气只部分溶于水;C:稀硫酸与铜不反应;故选D:不管产物如何, 4.6g的Na完全反应后必然失电子为0.2NA

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目
测定含I-浓度很小的碘化物溶液中的I-浓度时,可利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度.主要步骤有:
①在中性溶液中(15.00mL),用Cl2将试样中I-氧化成IO3-,将过量的Cl2除去;
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化为I2;
③将②中生成的碘完全萃取后,用肼将其还原成I-,化学方程式为N2H4+2I2=4I-+N2↑+4H+;
④将生成的I-萃取到水层后用①法处理;
⑤在④得到的溶液中加入足量的KI溶液,并用硫酸酸化;
⑥将⑤反应后的溶液以淀粉作指示剂,用0.1080mol?L-1的Na2S2O3标准溶液滴定,消耗标准液20.00mL(已知:2Na2S2O3+I2=Na2S4O6+2NaI).
下列有关叙述正确的是( )
①在中性溶液中(15.00mL),用Cl2将试样中I-氧化成IO3-,将过量的Cl2除去;
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化为I2;
③将②中生成的碘完全萃取后,用肼将其还原成I-,化学方程式为N2H4+2I2=4I-+N2↑+4H+;
④将生成的I-萃取到水层后用①法处理;
⑤在④得到的溶液中加入足量的KI溶液,并用硫酸酸化;
⑥将⑤反应后的溶液以淀粉作指示剂,用0.1080mol?L-1的Na2S2O3标准溶液滴定,消耗标准液20.00mL(已知:2Na2S2O3+I2=Na2S4O6+2NaI).
下列有关叙述正确的是( )
| A、将第⑤步得到的溶液再用肼还原,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等)18倍 | B、从上述转化可知,氧化性从强到弱的顺序为Cl2>IO3->S4O62->I2 | C、第③步反应中若生成2.24L气体(标准状况),则共转移电子0.6mol | D、原溶液中的I-浓度为0.0040 mol?L-1 |
【化学——选修化学与技术】(15分)现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下: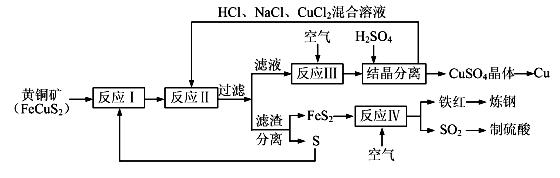
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl—=2[CuCl2]-+S
请回答下列问题:
(1)从黄铜矿冶炼粗铜的传统工艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。这种方法的缺点是 _____________________ ________、___________________________________ 。
(2)反应Ⅰ的产物为(填化学式) ___________________ 。
(3)反应Ⅲ的离子方程式为 ____________________________________________________ 。
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 ___________
(5)黄铜矿中Fe的化合价为+2,对于反应:8CuFeS2+21O2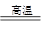 8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
8Cu+4FeO+2Fe2O3+16SO2,下列有关该反应的说法正确的是 ___________________ (填字母)。
| A.反应中被还原的元素只有氧 | B.反应生成的SO2直接排放会污染环境 |
| C.SO2既是氧化产物又是还原产物 | D.当有8mol铜生成时,转移电子数目为100NA |
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ____________________________________ 。
②反应Ⅳ所得气体中SO2的体积分数为________________________________________________ 。