题目内容
 乙酸乙酯能在多种条件下发生水解反应:
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O?CH3COOH+C2H5OH
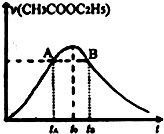
已知该反应的速率随c(H+)的增大而加快.如图为CH3COOC2H5的水解速率随时间的变化图.下列说法中正确的是( )
| A、反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致 | B、A、B两点表示的c(CH3COOC2H5)相等 | C、图中t0时反应达到平衡状态 | D、tB时CH3COOC2H5的转化率高于tA时CH3COOC2H5的转化率 |
分析:刚刚反应开始的时候,乙酸乙酯水解产生醋酸,量少,电离出的氢离子不断增加,反应速率不断加快.到tB后乙酸还在不断生成,但此时因为乙酸是弱酸,电离程度是有限的,此时氢离子浓度达到最大,以后虽还生成,但不再电离,氢离子不再是影响反应速率的因素.乙酸乙酯作为反应物不断减少,而生成物增加,对反应正向进行起抑制作用,速率减小.
解答:解:A.刚刚反应开始的时候,乙酸乙酯水解产生醋酸,量少,电离出的氢离子不断增加,反应速率不断加快,故A正确;
B.B点时乙酸乙酯不断水解,浓度逐渐降低,则A、B两点表示的c(CH3COOC2H5)不相等,故B错误;
C.图中to时表示乙酸乙酯水解速率最大,但没有达到平衡状态,故C错误;
D.乙酸乙酯作为反应物不断减少,而生成物增加,则tB时CH3COOC2H5的转化率高于tA时CH3COOC2H5的转化率,故D正确.
故选AD.
B.B点时乙酸乙酯不断水解,浓度逐渐降低,则A、B两点表示的c(CH3COOC2H5)不相等,故B错误;
C.图中to时表示乙酸乙酯水解速率最大,但没有达到平衡状态,故C错误;
D.乙酸乙酯作为反应物不断减少,而生成物增加,则tB时CH3COOC2H5的转化率高于tA时CH3COOC2H5的转化率,故D正确.
故选AD.
点评:本题考查影响化学反应速率的因素,题目难度中等,注意根据图象分析影响因素以及速率变化特点.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
 (2012?宜春模拟)乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O?CH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快.如图为CH3COOC2H5的水解速率随时间的变化图.下列说法正确的是( )
(2012?宜春模拟)乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O?CH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快.如图为CH3COOC2H5的水解速率随时间的变化图.下列说法正确的是( ) CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )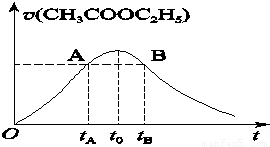
 CH3COOH+C2H5OH。
CH3COOH+C2H5OH。
 CH3COOH+C2H5OH。
CH3COOH+C2H5OH。