题目内容
已知下列几种烷烃的燃烧热如下:
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/(kJ?mol-1) | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
(1)试写出乙烷气体燃烧的热化学方程式:______;
(2)计算该天然气中甲烷的体积分数______;
(3)由上表可总结出的近似规律是______.
解:(1)由表中燃烧热数值可知,1mol乙烷燃烧生成二氧化碳与液态水,放出的热量为1559.8kJ,乙烷燃烧的热化学方程式为:C2H6(g)+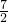 O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
故答案为:C2H6(g)+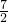 O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
(2)10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ,平均燃烧热为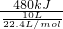 =1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比:
=1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比: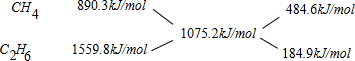
所以甲烷与乙烷的体积比为4846:1849,甲烷的体积分数为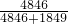 ×100%=72.38%
×100%=72.38%
故答案为:72.38%.
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加基本为定值.
乙烷与甲烷燃烧热相差:1559.8kJ/mol-890.3kJ/mol=669.5kJ/mol,
丙烷与乙烷燃烧热相差:2219.9kJ/mol-1559.8kJ/mol=660.1kJ/mol,
丁烷与丙烷燃烧热相差:2877.0kJ/mol-2219.9kJ/mol=657.1kJ/mol,
戊烷与丁烷燃烧热相差:3536.2kJ/mol-2877.0kJ/mol=659.2kJ/mol.
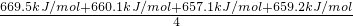 =661kJ/mol,
=661kJ/mol,
烷烃分子中每增加一个CH2燃烧热平均增加661kJ/mol左右.
故答案为:烷烃分子中每增加一个CH2燃烧热平均增加661kJ/mol左右.
分析:(1)由表中燃烧热数值可知,1mol乙烷燃烧生成二氧化碳与液态水,放出的热量为1559.8kJ,据此根据热化学方程式的书写原则书写.
(2)计算甲烷和乙烷混合气体的平均燃烧热,利用十字交叉法计算.
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加为定值,计算增加数值.
点评:考查热化学方程式的书写、反应热计算、燃烧热等,难度中等,(3)中为近似规律,旨在考查学生对数据的分析、归纳能力.
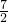 O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.故答案为:C2H6(g)+
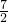 O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.
O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol.(2)10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ,平均燃烧热为
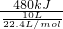 =1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比:
=1075.2kJ/mol,根据十字交叉法计算甲烷与乙烷的体积比: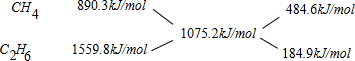
所以甲烷与乙烷的体积比为4846:1849,甲烷的体积分数为
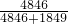 ×100%=72.38%
×100%=72.38%故答案为:72.38%.
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加基本为定值.
乙烷与甲烷燃烧热相差:1559.8kJ/mol-890.3kJ/mol=669.5kJ/mol,
丙烷与乙烷燃烧热相差:2219.9kJ/mol-1559.8kJ/mol=660.1kJ/mol,
丁烷与丙烷燃烧热相差:2877.0kJ/mol-2219.9kJ/mol=657.1kJ/mol,
戊烷与丁烷燃烧热相差:3536.2kJ/mol-2877.0kJ/mol=659.2kJ/mol.
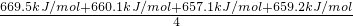 =661kJ/mol,
=661kJ/mol,烷烃分子中每增加一个CH2燃烧热平均增加661kJ/mol左右.
故答案为:烷烃分子中每增加一个CH2燃烧热平均增加661kJ/mol左右.
分析:(1)由表中燃烧热数值可知,1mol乙烷燃烧生成二氧化碳与液态水,放出的热量为1559.8kJ,据此根据热化学方程式的书写原则书写.
(2)计算甲烷和乙烷混合气体的平均燃烧热,利用十字交叉法计算.
(3)根据表中数据可知,碳原子数目相邻的烷烃的燃烧热之差,基本为定值,即烷烃分子中每增加一个CH2燃烧热平均增加为定值,计算增加数值.
点评:考查热化学方程式的书写、反应热计算、燃烧热等,难度中等,(3)中为近似规律,旨在考查学生对数据的分析、归纳能力.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
已知下列几种烷烃的燃烧热如下:
今有10L(在标准状况下)某种天然气,假设仅含甲烷和乙烷两种气体,燃烧时共放出热量480kJ.
(1)试写出乙烷气体燃烧的热化学方程式:______;
(2)计算该天然气中甲烷的体积分数______;
(3)由上表可总结出的近似规律是______.
| 烷烃 | 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 燃烧热/ | 890.3 | 1559.8 | 2219.9 | 2877.0 | 3536.2 |
(1)试写出乙烷气体燃烧的热化学方程式:______;
(2)计算该天然气中甲烷的体积分数______;
(3)由上表可总结出的近似规律是______.
