题目内容
【题目】下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
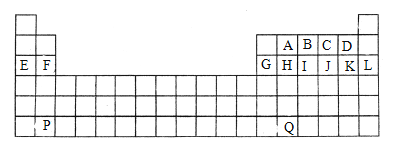
(1)在上表所列出的短周期元素中
①性质最不活泼的是____________;②原子半径最大的是(除稀有气体元素)__________。
③形成的气态氢化物最稳定的是______________________________;
④最高价氧化物对应的水化物中酸性最强的是____________碱性最强的是_____________。
⑤形成的阴离子还原性最弱的是_____________,阳离子半径最小的是_____________。
(2)①B的气态氢化物与最高价氧化物对应的水化物发生反应的化学方程式为________________;
②A单质与J的最高价氧化物对应的水化物反应的方程式________________________________。
(3)设P的原子序数为Z,则F的原子序数为______________,Q的原子序数为________________。
【答案】Ar Na HF HClO4 NaOH F- Al3+ NH3+HNO3=NH4NO3 C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O Z-44 Z+26
2SO2↑+CO2↑+2H2O Z-44 Z+26
【解析】
由元素在周期表中位置,可知A为碳、B为氮、C为氧、D为氟、E为Na、F为Mg、G为Al、H为Si、I为磷、J为S、K为Cl、L为Ar、P为Ba、Q为Pb。
(1)①稀有气体的性质最不活泼;②同周期自左而右原子半径减小,一般电子层越多原子半径越大;③非金属性越强,形成的气态氢化物越稳定;④非金属性越强,最高价氧化物对应的水化物中酸性越强,注意F没有最高正价;金属性越强,最高价氧化物对应的水化物中碱性越强;⑤非金属性越强,形成的阴离子还原性最弱越弱;电子层结构相同核电荷数越大离子半径越小,据此分析解答;
(2) ①B为氮元素,则氢化物为氨气,最高价的氧化物的水化物为硝酸,据此书写反应的化学方程式;②A为碳、J为S,据此书写碳和浓硫酸反应的化学方程式;
(3)P、F的原子序数之差为第三、第四、第五周期容纳元素种数之和;P、Q所在周期中第3列有15种元素,其它每列含有1种元素,据此分析解答。
(1)①Ar原子最外层为稳定结构,性质最不活泼,故答案为:Ar;
②同周期自左而右原子半径减小,一般电子层越多原子半径越大,故短周期中Na的原子半径最大,故答案为:Na;
③非金属性越强,氢化物越稳定,同周期自左而右非金属性增强,同主族自上而下非金属性减弱,短周期中F元素非金属性最强,气态氢化物HF最稳定,故答案为:HF;
④非金属性越强,最高价氧化物对应的水化物中酸性越强,由于F没有最高正价,因此短周期中最高价氧化物对应的水化物中酸性最强的是HClO4;金属性越强,最高价氧化物对应的水化物中碱性越强,短周期中Na的金属性最强,最高价氧化物对应的水化物中碱性最强的是NaOH,故答案为:HClO4;NaOH;
⑤F元素的非金属性最强,形成的阴离子(F-)还原性最弱;Na+、Mg2+、Al3+电子层结构相同,核电荷数越大离子半径越小,故阳离子半径最小的是:Al3+,故答案为:F-;Al3+;
(2) ①B为氮元素,则氢化物为氨气,最高价的氧化物的水化物为硝酸,二者反应生成硝酸铵,反应的化学方程式为NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
②A为碳、J为S,则碳和浓硫酸反应的化学方程式为C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(3)P、F的原子序数之差为第三、第四、第五周期容纳元素种数之和,设P的原子序数为Z,则F的原子序数为:Z-8-18-18=Z-44;P、Q相差14-2=12列,所在周期中第3列有15种元素,其它每列含有1种元素,故二者原子序数相差12+(15-1)=26,Q的原子序数为Z+26,故答案为:Z-44;Z+26。

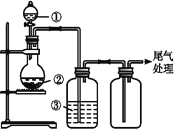
【题目】可用如图装置制取、净化、收集气体的是
选项 | 气体 | ① | ② | ③ |
|
A | NH3 | 浓氨水 | 生石灰 | 浓硫酸 | |
B | SO2 | 浓硫酸 | Na2SO3 | 浓硫酸 | |
C | NO2 | 浓硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | MnO2 | H2O |
A. A B. B C. C D. D
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
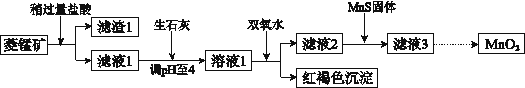
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)盐酸溶解MnCO3的化学方程是______________,滤渣1的主要成分为________________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________________,在CuS和MnS共存的悬浊液中,c(Cu2+)/c(Mn2+)=_____________ (Ksp(CuS)=1.2×10-36,Ksp(MnS)=2.5×10-13)。
(4)在酸性条件下,NaClO3溶液将MnCl2氧化为MnO2,其还原产物为Cl2,该反应的离子方程式为 ___________________ 。
【题目】欲降低废水中重金属元素铬的毒性,可将![]() 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:
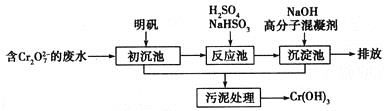
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________。
②请补充并配平以下反应池中发生主要反应的离子方程式:____![]() +____
+____![]() +____===____Cr3++____
+____===____Cr3++____![]() +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________。证明Cr3+沉淀完全的方法是_____________________________________________________________。
(2)工业可用电解法来处理含![]() 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含![]() 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
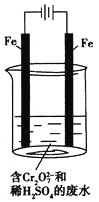
①Fe2+与酸性溶液中的![]() 反应的离子方程式是______________________________。
反应的离子方程式是______________________________。
② 若溶液中含有0.01 mol ![]() ,则阳离子全部生成的沉淀的物质的量是______mol。
,则阳离子全部生成的沉淀的物质的量是______mol。