题目内容
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示,其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
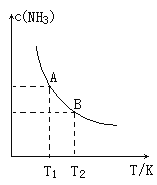
①该反应的焓变△H__0(填“>”或“<”)判断依据为_____。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______。
③T1温度下该反应的化学平衡常数K1=______。
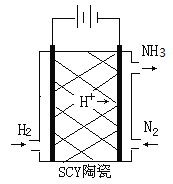
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
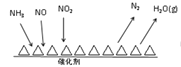
①SCR技术中的氧化剂为__________________。
②当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______________。当有3 mol电子发生转移时,则参与反应的NO的物质的量为____________。
【答案】< 温度升高,氨气的浓度降低,说明正反应为放热反应 8.00×10﹣3mol/(Lmin) 18.3 N2+6H++6e﹣=2NH3 NO、NO2 2NH3+NO2+NO=2N2+3H2O 0.5 mol
【解析】
(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度,化学平衡向逆反应方向移动,平衡常数减小;
②根据化学反应速率的计算公式带入数据即可;
③根据K=c2(NH3)/c(N2)c3(H2)计算平衡常数;
(2)根据阴极发生得到电子的还原反应;
(3)①根据图以及氧化还原反应间的关系进行判断;
②根据化合价进行分析。
(1)①根据图像中氨气的平衡含量与温度的关系可知:升高温度,氨气的平衡浓度降低,说明升高温度,化学平衡向逆反应方向移动,说明该反应的正反应放热反应。当温度由T1变化到T2时,平衡常数关系K1>K2;由于该反应的正反应是放热反应,所以△H<0,故答案为:<;温度升高,氨气的浓度降低,说明正反应为放热反应。
②该反应在T1温度下5.0min达到平衡,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,根据反应方程式N2(g)+3H2(g)=2NH3(g)可知:每有1molN2发生反应会产生2molNH3,气体的物质的量减少2mol,假设反应的氮气的物质的量是x,则反应的氢气的物质的量是3x,反应产生2x,反应后的气体的物质的量减小2x,反应后混合气体的总物质的量是(1mol+3mol-2xmol),其中温度为T1时平衡混合气体中氨气的体积分数为25.0%,2x÷(1mol+3mol-2xmol)=25.0%,解得x=0.4mol,则这段时间内N2的化学反应速率为0.4mol÷10L÷5.0min=8.00×10﹣3mol/(Lmin),故答案为:8.00×10﹣3mol/(Lmin)。
③T1温度下,反应处于平衡状态时,c(NH3)=0.8mol÷10.0L=0.08mol/L,c(N2)=(1mol-0.4mol)÷10.0L=0.06mol/L;c(H2)=(3mol-3×0.4mol)÷10.0L=0.18mol/L,则根据化学平衡常数的含义可得该反应的化学平衡常数K1=c2(NH3)/c(N2)c3(H2)=0.082/0.06×0.183=18.3,故答案为:18.3。
(2)电解池中阴极发生得到电子的还原反应,则阴极是氮气得到电子结合氢离子转化为氨气,电极方程式为:N2+6H++6e﹣=2NH3,故答案为:N2+6H++6e﹣=2NH3。
(3)①由反应原理图可知SCR技术中,反应物是NH3与NO、NO2,产物为N2和水,氮氧化物中N元素化合价由正化合价变为0价、氨气中N元素化合价由-3价变为0价,故氧化剂为NO、NO2,故答案为:NO、NO2。
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO2+NO=2N2+3H2O,当有3 mol电子发生转移时,则参与反应的NO的物质的量为0.5mol,故答案为:2NH3+NO2+NO=2N2+3H2O;0.5 mol。

 名校课堂系列答案
名校课堂系列答案【题目】已知反应X(g)+Y(g)![]() R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表所示。830 ℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005 mol/(L·s)。下列说法正确的是
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830 ℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1 200 ℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
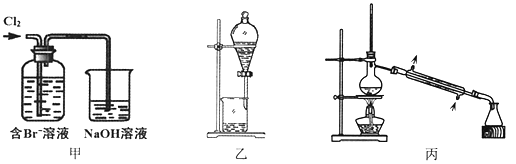
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2