题目内容
【题目】下列反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质甲是金属,化合物A为烧碱,写出该反应的离子方程式:______________________
(2)若工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式______________
(3)若单质乙是黑色非金属固体单质,化合物B是一种白色金属氧化物,则该反应的化学方程式 ________________________
(4)若化合物B为黑色磁性晶体,单质乙为气体,写出该反应的化学方程式___________________
【答案】 2Al+2OH-+2H2O====2AlO2-+3H2↑ 2C+SiO2 ![]() Si+2CO↑ 2Mg+CO2
Si+2CO↑ 2Mg+CO2![]() 2MgO+C 3Fe+4H2O(g)
2MgO+C 3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
【解析】(1)金属单质能够与强碱溶液发生反应为铝,铝与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,反应的离子方程式:2Al+2OH-+2H2O====2AlO2-+3H2↑;正确答案:2Al+2OH-+2H2O====2AlO2-+3H2↑。
(2)二氧化硅与碳高温下反应生成一氧化碳和硅,硅即为半导体材料,该反应的化学方程式:2C+SiO2 ![]() Si+2CO↑ ;正确答案:2C+SiO2
Si+2CO↑ ;正确答案:2C+SiO2 ![]() Si+2CO↑ 。
Si+2CO↑ 。
(3)金属镁在二氧化碳气体中燃烧,生成白色固体氧化镁和黑色固体碳,反应的化学方程式 2Mg+CO2![]() 2MgO+C ;正确答案:2Mg+CO2
2MgO+C ;正确答案:2Mg+CO2![]() 2MgO+C。
2MgO+C。
(4)若化合物B为黑色磁性晶体,则B为四氧化三铁,金属铁和水蒸气高温下反应生成四氧化三铁和氢气,符合题意;反应的化学方程式3Fe+4H2O(g)![]() Fe3O4+4H2;正确答案:3Fe+4H2O(g)
Fe3O4+4H2;正确答案:3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。

 名校课堂系列答案
名校课堂系列答案【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()
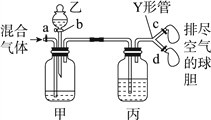
甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D
【题目】(12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
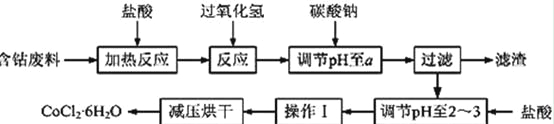
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。