题目内容
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏低的是
① 容量瓶用蒸馏水洗涤但没有干燥
② 定容时仰视刻度线
③ 没有洗涤溶解NaCl固体的烧杯和玻璃棒
④ 称量NaCl固体时所用砝码生锈了
A. ①③ B. ②③ C. ①②③ D. 全部
【答案】B
【解析】
① 容量瓶用蒸馏水洗涤但没有干燥,不会影响结果;② 定容时仰视刻度线,液面在刻度线上方,溶液体积增加,浓度偏低;③ 没有洗涤溶解NaCl固体的烧杯和玻璃棒,导致溶质减少,浓度偏低;④ 称量NaCl固体时所用砝码生锈了,导致溶质质量增加,浓度偏高,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
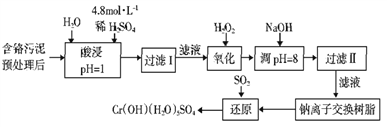
小学生10分钟应用题系列答案【题目】某工厂对工业污泥中的Cr元素回收与再利用的工艺如下(已知硫酸浸取液中的金属离子主要是Cr3+,其次是少量的Fe2+、Fe3+、Al3+、Ca2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | —— | —— | —— |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1)实验室用98%(密度为1.84g·cm-3)的浓硫酸配制200 mL 4.8 mol·L-1的硫酸溶液,配制时需要量取98%的浓硫酸的体积为_______ mL(保留小数点后一位小数),所用的玻璃仪器除烧杯、玻璃棒、量筒和酸式滴定管外,还需_______。
(2)过滤操作时,需要对沉淀进行洗涤,洗涤沉淀的方法是_______。
(3)加入H2O2的作用一方面是氧化+3价Cr使之转变成+6价Cr(CrO42-或Cr2O72-),以便于与杂质离子分离:另一方面是_______。(离子方程式表示)
(4)调节溶液的pH=8除去的杂质离子是_______。
(5)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是_______。
(6)通SO2气体时,还原过程发生以下反应(填写缺项物质并配平):
____ Na2Cr2O7+ SO2+ = Cr(OH)(H2O)5SO4+ Na2SO4。
【题目】根据下列实验现象所得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2> KBrO3 |
B | 向KNO3和KOH混合溶液中加入铝粉并加热, 将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
C | 向0.1 molL-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
D | 将0. 1 mol L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1 molL-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
A. A B. B C. C D. D