题目内容
已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好。如表中由实验现象得出的结论完全正确的是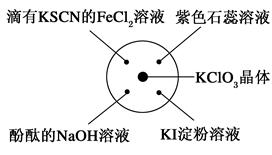
| 选项 | 实验现象 | 结论 |
| A | 滴有KSCN的FeCl2溶液变红色 | Cl2具有还原性 |
| B | 滴有酚酞的NaOH的溶液褪色 | Cl2具有酸性 |
| C | 石蕊溶液先变红后褪色 | Cl2具有漂白性 |
| D | 淀粉KI溶液中变为蓝色 | Cl2具有氧化性 |
D
解析试题分析:A.发生反应:2FeCl2+Cl2=2FeCl3. 氯气有氧化性,把Fe2+氧化为Fe3+。继而发生反应:Fe3++ SCN-=Fe(SCN)3. Fe(SCN)3是血红色的。错误。B. 酚酞是酸碱指示剂,遇碱变红色,遇酸不变色。Cl2+ H2O=HCl+HClO.当加入氢氧化钠以后,HCl+NaOH="NaCl+" H2O;NaOH+HClO=NaClO+H2O.由于酸不断消耗,溶液的酸性减弱,所以红色褪去。错误。C. Cl2+H2O="HCl+HClO." HCl、HClO都是酸,酸使紫色石蕊试液变为红色,但由于HClO还有强的氧化性,能把有色物质氧化为无色物质。故又变为无色。错误。D.氯气有氧化性,能把I-氧化为I2单质。 Cl2+2I-=2Cl-+I2. I2遇淀粉溶液变为蓝色。
考点:考查氯元素的单质及化合物HClO的化学性质的知识。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是
| 选项 | X | Y |
| A | SO2 | Cl2 |
| B | NO2 | SO2 |
| C | NH3 | CO2 |
| D | Cl2 | CO2 |
我们看到的普通玻璃一般呈淡绿色,这是因为在制造玻璃的过程中加入了( )
| A.氧化钴 | B.二价铁 |
| C.氧化亚铜 | D.氧化镁 |
下列说法:①硅的化学性质很稳定,因此硅在自然界中以游离态形式存在;②二氧化硅和二氧化碳在物理性质上有很大差异;③二氧化硅是一种酸性氧化物,它不可于任何酸发生反应。其中正确的是
| A.①②③ | B.①② | C.①③ | D.② |
下列说法正确的是
| A.水泥、玻璃、陶瓷、水晶都属于硅酸盐产品 |
| B.二氧化碳通入水玻璃可以得到硅酸 |
| C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以酸性硅酸比碳酸强 |
| D.可以用澄清石灰水鉴别SO2和CO2 |
下列物质中不属于硅酸盐的是
| A.陶瓷 | B.玻璃 | C.水晶 | D.水泥 |
下列实验现象和结论一致,正确的是
| A.氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B.氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C.氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D.氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
为除去镀在铝表面的铜镀层,可选用的试剂是( )
| A.稀HNO3 | B.浓HNO3 | C.浓H2SO4 | D.浓HCl |