题目内容
一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,下列说法正确的是( )
| A.60s时Z的平衡浓度为0.03mol/L |
| B.将容器容积变为20L,Z的新平衡浓度将等于原平衡浓度的一半 |
| C.若温度和体积不变,往容器内增加1molX,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
一定条件下,在容积为10L的密闭容器中,将1molX和1molY进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,则
2X(g)+Y(g)?Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A、60s时Z的平衡浓度=
=0.03mol/L,故A正确;
B、将容器容积变为20L,不考虑平衡移动,Z的新平衡浓度将等于原平衡浓度的一半,压强减小,平衡正向进行,Z的浓度大于原来的一半,故B错误;
C、若温度和体积不变,往容器内增加1molX,平衡正向进行,Y的转化率将增大,故C正确;
D、若升高温度,X的体积分数增大,说明平衡逆向进行,逆向是吸热反应,则正反应是放热反应,反应的△H<0,故D错误;
故选:AC.
2X(g)+Y(g)?Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A、60s时Z的平衡浓度=
| 0.3mol |
| 10L |
B、将容器容积变为20L,不考虑平衡移动,Z的新平衡浓度将等于原平衡浓度的一半,压强减小,平衡正向进行,Z的浓度大于原来的一半,故B错误;
C、若温度和体积不变,往容器内增加1molX,平衡正向进行,Y的转化率将增大,故C正确;
D、若升高温度,X的体积分数增大,说明平衡逆向进行,逆向是吸热反应,则正反应是放热反应,反应的△H<0,故D错误;
故选:AC.

练习册系列答案
相关题目
 2H2+O2 2CO+O2
2H2+O2 2CO+O2
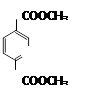 的同分异构体有多种,满足下列条件的共有 种。
的同分异构体有多种,满足下列条件的共有 种。