题目内容
下列属于右边关系图中阴影部分的化学反应是
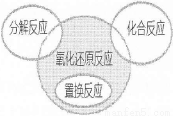
A.2Na+O2 Na2O2
Na2O2
B.2Na2O2+2CO2=2Na2CO3+O2
C.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.Fe+H2SO4=FeSO4+H2↑
B
【解析】
试题分析:A、钠燃烧属于化合反应,错误;B、氧元素化合价既升高又降低,属于氧化还原反应,但不是置换反应,正确;C、高锰酸钾发生分解反应,错误;D、铁与稀硫酸发生置换反应,错误。
考点:考查化合反应的分类、氧化还原反应的特征等相关知识。

草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有 。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1: ;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
实验步骤 | 实验现象 | 实验结论 |
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡。 | 若溶液颜色明显改变, 且有红色固体生成。 | 有Fe存在。
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 |
|
|
步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液, 。 |
。 | 有FeO存在。
|
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为 (写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式 。
下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 |
|
|
|
| ① |
| ② |
|
三 | ③ | ④ | ⑤ | ⑥ |
|
| ⑦ | ⑧ |
四 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)在这些元素中,金属性最强的元素是
(2)化学性质最不活泼的元素其原子结构示意图为 ;
(3)元素的最高价氧化物对应的水化物中酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(4)在③~⑦元素中,原子半径最大的是 ,原子半径最小的是 ;
(5)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。