题目内容
卤水中的主要成分为食盐(假设其所含杂质仅为NaBr),为了充分利用资源,有研究人员开发了以晒盐卤水和化肥碳酸氢铵为原料制取纯碱的工艺,其生产流程如下图.
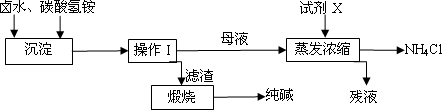
(1)写出卤水和碳酸氢铵反应的化学方程式________;
(2)操作I是________(填操作名称),试剂X为________,残液除NH4Cl外,还含有________;
(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式________;
(4)实验室检测滤渣中是否含有NH4Cl的操作是________;
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,如图是![]() (摩尔比)对NaHCO3产率的影响.实际生产中选择
(摩尔比)对NaHCO3产率的影响.实际生产中选择![]() =1.2.
=1.2.
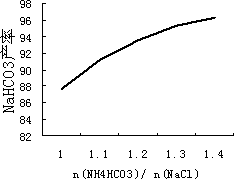
①下列相关说法正确的是________.
a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1 mol纯碱,需消耗碳酸氢铵________mol.
答案:
解析:
解析:
(1)NaCl+NH4HCO3
→NaHCO3↓+NH4Cl(2分)(2)过滤、洗涤(2分) 盐酸(1分) NH4Br(或NaBr)(1分)
(3)NaHCO3+NH4Cl![]() NaCl+NH3
NaCl+NH3
(4)取洗涤液,加入足量硝酸至溶液呈酸性,再滴加硝酸银溶液,无沉淀说明纯净(答案合理即可,1分)
(5)①bc(2分)
②2.4 mol(1分)

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目






 (摩尔比)对NaHCO3产率的影响.实际生产中选择
(摩尔比)对NaHCO3产率的影响.实际生产中选择
 (5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
 (5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。