题目内容
将100mL0.6mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,得到3.9gAl(OH)3沉淀,此时消耗氢氧化钠溶液的体积是( )
| A.130mL | B.180mL | C.190mL | D.240mL |
100mL0.6mol/L氯化铝溶液跟1mol/L氢氧化钠溶液混合后,如完全转化为gAl(OH)3沉淀,则生成沉淀的质量为0.6mol/L×0.1L×78g/mol=4.68g,
而此时为3.9g,说明氯化铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=
=0.05mol,NaOH可能有两种情况,一是不足,二是使Al(OH)3部分溶解,
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol1mol
x 0.05mol
则x=0.15mol,
V1(NaOH溶液)=
=0.15L=150mL,
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.06mol 0.18mol
②Al(OH)3+OH-=AlO2-+H2O
1mol1mol
(0.06-0.05)mol (0.06-0.05)mol=0.01mol
两步反应共需要0.18mol+0.01mol=0.19mol,
V2(NaOH溶液)=
=0.19L=190mL,
只有C符合,
故选C.
而此时为3.9g,说明氯化铝并没有完全转化为Al(OH)3,此时n(Al(OH)3)=
| 3.9g |
| 78g/mol |
当NaOH不足时,
Al3++3OH-=Al(OH)3↓
3mol1mol
x 0.05mol
则x=0.15mol,
V1(NaOH溶液)=
| 0.15mol |
| 1mol/L |
如使Al(OH)3部分溶解,则
①Al3++3OH-=Al(OH)3↓
0.06mol 0.18mol
②Al(OH)3+OH-=AlO2-+H2O
1mol1mol
(0.06-0.05)mol (0.06-0.05)mol=0.01mol
两步反应共需要0.18mol+0.01mol=0.19mol,
V2(NaOH溶液)=
| 0.19mol |
| 1mol/L |
只有C符合,
故选C.

练习册系列答案
相关题目
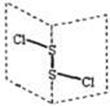
 ( )
( ) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O