题目内容
A是一种无色透明的晶体,进行如下实验:
①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色.
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊试液变红.
③取少量A的溶液加过量氨水,有白色沉淀B生成.
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸.
⑤取少量B滴加氢氧化钠溶液,得无色溶液D.
⑥取少量B滴加盐酸,得无色溶液E.
⑦将47.4g A晶体在120℃下加热脱水,剩余物的质量为25.8g.
根据上述实验现象和结果回答下列问题:
(1)确定A、B、D、E,写出它们的化学式.
A______ B______ D______ E______
(2)写出下列实验步骤中的离子反应:
⑤______;⑥______.
解:①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色.证明A中含钾元素;
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊试液变红.说明溶液呈酸性;
③取少量A的溶液加过量氨水,有白色沉淀B生成.说明生成金属的氢氧化物沉淀不溶于氨水;
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸.证明A中含有硫酸根离子;
⑤取少量B滴加氢氧化钠溶液,得无色溶液D.结合⑤⑥分析氢氧化物溶于强酸强碱,证明B是两性氢氧化物,判断为Al(OH)3,滴加氢氧化钠溶液,得无色溶液D为NaAlO2;
⑥取少量B滴加盐酸,得无色溶液E.氢氧化铝溶于盐酸生成氯化铝溶液,E为AlCl3;
⑦将47.4g A晶体在120℃下加热脱水,剩余物的质量为25.8g.可知失去结晶水的质量47.4g-25.8g=21.6g,结合上述判断可知A中含钾元素铝元素,硫酸根离子,依据化合价代数和为0,得到化学式为KAl(SO4)2,质量为25.8g,物质的量= =0.1mol;结晶水物质的量=
=0.1mol;结晶水物质的量=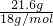 =1.2mol,推断得到A的化学式为:KAl(SO4)2?12H2O
=1.2mol,推断得到A的化学式为:KAl(SO4)2?12H2O
故答案为:(1)KAl(SO4)2?12H2O;Al(OH)3;NaAlO2 ; AlCl3;
(2)⑤是氢氧化铝溶于氢氧化钠溶液中,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;⑥是氢氧化铝溶于盐酸溶液中,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O;
分析:①依据现象判断含钾元素;
②说明溶液呈酸性;
③说明白色沉淀不溶于氨水,A中含有金属阳离子;
④现象说明含有硫酸根离子;
⑤说明白色沉淀溶于氢氧化钠,说明B沉淀是氢氧化铝;溶解后生成偏铝酸钠;
⑥白色沉淀B溶于盐酸,进一步证明B是两性氢氧化物为氢氧化铝;
⑦阳极质量计算失水质量分析计算晶体中的结晶水;
点评:本题考查了物质推断的方法,离子方程式的书写,盐类水解应用,盐酸焰色反应的应用,主要考查实验现象的应用判断离子存在,氢氧化铝的两性应用,定律计算物质化学式的确定,题目难度中等.
②取少量A晶体溶于水可以得到无色的溶液,该溶液使石蕊试液变红.说明溶液呈酸性;
③取少量A的溶液加过量氨水,有白色沉淀B生成.说明生成金属的氢氧化物沉淀不溶于氨水;
④过滤除去③中的B后,在滤液中滴加氯化钡溶液,有白色沉淀C生成,C不溶于稀硝酸.证明A中含有硫酸根离子;
⑤取少量B滴加氢氧化钠溶液,得无色溶液D.结合⑤⑥分析氢氧化物溶于强酸强碱,证明B是两性氢氧化物,判断为Al(OH)3,滴加氢氧化钠溶液,得无色溶液D为NaAlO2;
⑥取少量B滴加盐酸,得无色溶液E.氢氧化铝溶于盐酸生成氯化铝溶液,E为AlCl3;
⑦将47.4g A晶体在120℃下加热脱水,剩余物的质量为25.8g.可知失去结晶水的质量47.4g-25.8g=21.6g,结合上述判断可知A中含钾元素铝元素,硫酸根离子,依据化合价代数和为0,得到化学式为KAl(SO4)2,质量为25.8g,物质的量=
 =0.1mol;结晶水物质的量=
=0.1mol;结晶水物质的量=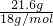 =1.2mol,推断得到A的化学式为:KAl(SO4)2?12H2O
=1.2mol,推断得到A的化学式为:KAl(SO4)2?12H2O 故答案为:(1)KAl(SO4)2?12H2O;Al(OH)3;NaAlO2 ; AlCl3;
(2)⑤是氢氧化铝溶于氢氧化钠溶液中,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;⑥是氢氧化铝溶于盐酸溶液中,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;Al(OH)3+3H+=Al3++3H2O;
分析:①依据现象判断含钾元素;
②说明溶液呈酸性;
③说明白色沉淀不溶于氨水,A中含有金属阳离子;
④现象说明含有硫酸根离子;
⑤说明白色沉淀溶于氢氧化钠,说明B沉淀是氢氧化铝;溶解后生成偏铝酸钠;
⑥白色沉淀B溶于盐酸,进一步证明B是两性氢氧化物为氢氧化铝;
⑦阳极质量计算失水质量分析计算晶体中的结晶水;
点评:本题考查了物质推断的方法,离子方程式的书写,盐类水解应用,盐酸焰色反应的应用,主要考查实验现象的应用判断离子存在,氢氧化铝的两性应用,定律计算物质化学式的确定,题目难度中等.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目