题目内容
如图,四种装置中所盛的溶液体积均为200mL,浓度为0.6mol?L-1,工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是( )
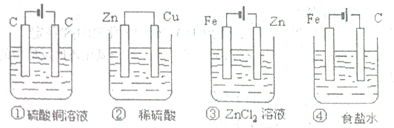

分析:①③④是电解池,②是原电池,①中阳极上析出氧气,阴极上析出铜,所以电解质溶液酸性增强;②中正极上氢离子放电生成氢气,所以溶液的酸性减弱;③是电镀池,所以pH不变,④阳极上生成氯气,阴极上生成氢气,所以导致溶液中pH增大.
解答:解:①是电解CuSO4,电解方程式为:2H2O+2Cu2+
2Cu+O2↑+4H+,根据方程式知生成4mol氢离子转移4mol电子,生成当转移0.2mol电子时氢离子浓度=
=1mol/L,pH=0;
②装置为原电池,铜电极上氢离子得电子生成氢气,根据2H++2e-═H2↑知,当转移0.2mol电子时溶液中氢离子浓度=0.6mol/L×2-
=0.2mol/L;
③该装置实际上是一个电镀池,pH值不变,为强酸弱碱盐,溶液呈弱酸性;
④装置为电解NaCl饱和溶液,生成NaOH,为强碱溶液,pH值最大,所以pH大小顺序是④③②①,
故选:C.
| ||
| ||
| 0.2L |
②装置为原电池,铜电极上氢离子得电子生成氢气,根据2H++2e-═H2↑知,当转移0.2mol电子时溶液中氢离子浓度=0.6mol/L×2-
| ||
| 0.2L |
③该装置实际上是一个电镀池,pH值不变,为强酸弱碱盐,溶液呈弱酸性;
④装置为电解NaCl饱和溶液,生成NaOH,为强碱溶液,pH值最大,所以pH大小顺序是④③②①,
故选:C.
点评:本题考查了原电池和电解池原理,明确离子放电顺序是解本题关键,结合化学反应方程式进行分析解答,难度中等.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
如图,四种装置中所盛的溶液体积均为500mL, 浓度均为0.4 mol·L-1
浓度均为0.4 mol·L-1 ,工作一段时间后,测得导线上均通过了0.10mol电子,此时溶液中的pH由大到小的顺序是]
,工作一段时间后,测得导线上均通过了0.10mol电子,此时溶液中的pH由大到小的顺序是]
| A.①②③④ | B.②①③④ | C.③①②④ | D.④③①② |


