题目内容
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
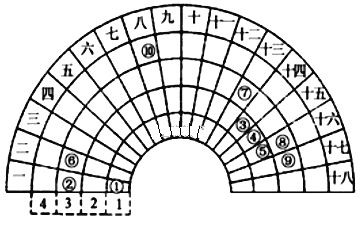
A. ⑥、⑧、⑨对应单核离子的半径依次增大
B. ⑤的三种核素的化学性质不相同
C. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
D. ⑧、⑨两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
【答案】C
【解析】试题分析:对比中学常见元素周期表思考扇形元素周期表的填充规律知①为氢元素,②为钠元素,③为碳元素,④为氮元素,⑤为氧元素,⑥为镁元素,⑦为铝元素,⑧为硫元素,⑨为氯元素,⑩为铁元素。A、镁元素、硫元素、氯元素对应单核离子的半径:S2->Cl->Mg2+,错误;B、⑤为氧元素,其三种核素的化学性质几乎相同,错误;C、④为氮元素,其的最高价氧化物对应的水化物硝酸能与其氢化物氨气反应生成离子化合物硝酸铵,正确;D、⑧为硫元素,硫元素气态氢化物H2S为弱酸,错误。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如表:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1KMnO4 酸性溶液 |
② | 20 mL 0.2 molL﹣1 H2C2O4 溶液 | 30 mL 0.01 molL﹣1 KMnO4酸性溶液 |

(1)检验如图装置气密性的最简便方法为: .
(2)H2C2O溶液与酸性 KMnO4溶液反应的化学方程式为 .
(3)该实验探究的是因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是(填实验序号).
(4)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)=(若忽略溶液混合前后体积的变化).
(5)小组同学发现反应速率总是如图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①、②、③K+对该反应有催化作用.