题目内容
某化工厂每小时生产98%(质量分数)硫酸a t(吨),为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,求:
(1)该厂每小时消耗标准状况下空气的体积。
(2)为满足题设需求,b%的下限。
(1)![]() ;(2)7%。
;(2)7%。
解析:
第(1)小题要求对燃烧前后气体体积之间的关系以及对题中b%的含义有清楚的理解,才能迅速、正确地列出算式。解第(2)小题时可以按照第(1)小题的思路进行计算,也可从生成SO2和SO3两反应耗O2的关系,以及空气中氧气的体积分数,即可得出结果。
(1)每小时生产纯硫酸为:
![]() =a×104 mol,因而产生过程中生成的SO2和SO3都是a×104 mol。设每小时消耗空气的体积为V m3,根据S+O2====SO2,消耗的氧气体积等于生成的SO2的体积,因而燃烧前空气的体积等于燃烧后混合气体的体积。由此得出以下关系:空气中O2的体积=反应消耗的O2体积+燃烧后混合气体中的O2体积,即V×0.21=a×104 mol×22.4 L·mol-1×10-3+V×b%,化简后得:V=
=a×104 mol,因而产生过程中生成的SO2和SO3都是a×104 mol。设每小时消耗空气的体积为V m3,根据S+O2====SO2,消耗的氧气体积等于生成的SO2的体积,因而燃烧前空气的体积等于燃烧后混合气体的体积。由此得出以下关系:空气中O2的体积=反应消耗的O2体积+燃烧后混合气体中的O2体积,即V×0.21=a×104 mol×22.4 L·mol-1×10-3+V×b%,化简后得:V=![]() 。
。
(2)解法一:由反应方程式S+O2====SO2和2SO2+O2====2SO3可知,S燃烧生成SO2需O2为a×104 mol,SO2氧化为SO3又需O2为0.5a×104 mol,总共需要O21.5a×104 mol,折算成空气的物质的量为:![]() ,此值也即为燃烧后混合气体的体积,则可得:b%=0.5
,此值也即为燃烧后混合气体的体积,则可得:b%=0.5 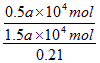 =7%。
=7%。
解法二:题中“b的下限”其含义是指燃烧后剩余的O2在第二步催化氧化时恰好完全反应,也就是说,燃烧前的氧气恰好满足两步反应。根据化学方程式,两步反应耗氧气之比为2∶1。
所以燃烧后(第一步反应后)混合气体中氧气的体积分数的下限为:b%=1/3×21%=7%。

 阅读快车系列答案
阅读快车系列答案