题目内容
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。

试回答下列问题
(1)元素“O”在周期表中的位置是 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为: ;序列“1”氢化物的电子式为: 。

试回答下列问题
(1)元素“O”在周期表中的位置是 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为: ;序列“1”氢化物的电子式为: 。
(1)第四周期第Ⅷ族; (2)[He]2s22p2(3)m(4)CH4; 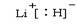
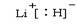
试题分析:(1)根据给出的元素周期表可确定元素“O”在周期表中的位置是第四周期第Ⅷ族。(2)“c”在元素周期表中位于第二周期第ⅣA。该元素是C。的简化电子排布式是[He]2s22p2。(3)第三周期8种元素有Na、Mg、Al、Si、P、S、Cl、Ar。同一周期的元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,其金属单质的熔点就越低。元素的非金属性越强,其单质的熔沸点就越高。其中序列“1”的熔点最低,代表的是Ar。字母代号为m.(4)b、c、d、e、f分别是Li、C、N、O、F。在这些元素形成的氢化物中LiH是离子晶体,其余的都是分子晶体。离子晶体通过离子键结合,断裂较难,所以沸点最高,而在其余的氢化物中,由于HF、H2O、NH3的分子间存在分子间作用力和氢键,所以沸点高于同主族其它元素形成的氢化物的沸点。而CH4则符合一般的规律。即相对分子质量越大,分子间作用力就越大,物质的沸点就越高。由于CH4式量最小,分子间以分子间作用力结合,所以沸点最低。序列“5”氢化物的化学式为:CH4;序列“1”氢化物的LiH,其电子式为:
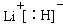 。
。
练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目