��Ŀ����
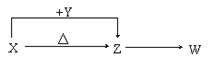
����Ŀ��X��Y��Z��W���ֳ������������X��������Ԫ�أ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��WΪ��ɫ��ζ���塣�����ֻ������������ת����ϵ(���ַ�Ӧ����P��Ӧ��������ȥ)��
��ش�
��W�Ļ�ѧʽ��____________________��
��X��Y����Һ�з�Ӧ�����ӷ���ʽ��________________________��
�Ǣٽ�4.48 L(������Ϊ��״��)Wͨ��100 mL 3 mol/L��Y��ˮ��Һ����Һ�е�������_________��
����Ȼ���д���X��Z��H2O��һ�������ᾧ���ɵĹ��塣ȡһ�����ù�������ˮ���100 mL��Һ�������Һ�н��������ӵ�Ũ��Ϊ0.5 mol/L����ȡ��ͬ�����Ĺ�����������أ�ʣ����������Ϊ____________ g��
��ѡ��X�����е�����Ԫ���е����ֻ�������ɵĻ������������ͼװ��(�г̶ֹ�װ������ȥ)����ʵ�飬װ�â��в�����ɫ������װ�â��п��ռ���һ����ɫ��ȼ�����塣

��װ�â��з�Ӧ�Ļ�ѧ����ʽ��___________________________________��
װ�â������ʵĻ�ѧʽ��_____________��
����X���е�����Ԫ���е�������ɵ�ij������ڴ����������Ʊ����ռ����������װ�â������壬�û�����Ļ�ѧʽ��_______________����������װ����________________(����ͼѡ���Ҫװ�ã���д���)��
���𰸡� CO2 HCO3-+ OH-= CO32- + H2O Na2CO3��NaHCO3 2.65 Na2CO3 + H2SO4 = Na2SO4 + CO2��+ H2O Na2O2 H2O2 ������
�����������⿼�����ƶϣ�X��Y��Z����ɫ��Ӧ��Ϊ��ɫ��˵��������Ԫ�أ�WΪ��ɫ��ζ�����壬�Լ�WΪ�������WΪCO2������ת����ϵ���Ƴ�XΪNaHCO3��ZΪNa2CO3��YΪNaOH����1����������������WΪCO2����2�����������ӷ���ʽΪHCO3����OH��=CO32����H2O����3����CO2��NaOH��Ӧ���ɵ�����ΪNa2CO3��NaHCO3�����ٴ���һ�֣�����Na2CO3���ʵ���Ϊxmol��NaHCO3���ʵ���Ϊymol�����������У�x��y=4.48/22.4��2x��y=100��10��3��3�����x=0.1mol��y=0.1mol���������ΪNa2CO3��NaHCO3���ڼ��������أ��˹���ΪNa2CO3��������Ԫ���غ㣬���ʣ����������Ϊ100��10��3��0.5��106/2g=2.65g����4��װ��III�в�����ɫ��������ͨ��III�е������к���CO2��������X�����е�����Ԫ�������ֻ�������ɻ������XΪNa2CO3����װ��I�з����ķ�Ӧ��Na2CO3��H2SO4=Na2SO4��CO2����H2O��V���ռ�����ȼ���壬��������ΪO2���Ƴ�װ��II������ΪNa2O2�����ռ���������Ϊ��������XΪH2O2����Ϊ�ռ����������O2����Ҫ�õ�������I��IV��V��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�