题目内容
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该反应的氧化剂是 ,氧化产物是 ,用双线桥法表示上述反应电子转移方向和数目;
(2)计算当有73.0克HCl被氧化时,消耗MnO2的物质的量为 ;
(3)在反应MnO2+4HCI MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
MnCl2+C12↑+2H2O中,当有0.2mol电子转移时,产生氯气的体积(标准状况)是 。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关实验的操作正确的是( )
实验 | 操作 | |
A | 浓盐酸与MnO2反应制备干燥纯净的Cl2 | 将气体产物先通过饱和食盐水,后通过浓硫酸 |
B | 配制稀硫酸 | 直接将浓硫酸注入容量瓶中加水稀释 |
C | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,再从下口放出水层 |
D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |


 TiO2+ H2O
TiO2+ H2O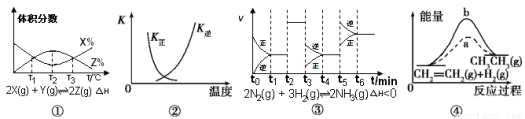
 2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化
2SO3(g),ΔH<0正、逆反应的平衡常数K随温度的变化 CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化
CH3CH3(g) ΔH<0使用和未使用催化剂时, 反应过程中的能量变化 .1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
.1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1