题目内容
某元素最高价氧化物化学式为RO2,其中R元素的质量分数为27.27%。对此元素叙述正确的是( )
| A.该元素是第二周期ⅣA族的元素 |
| B.该元素所形成的气态氢化物中含H量一定为25% |
| C.RO2与水反应能生成强酸 |
| D.石油的成分主要是该元素与氢形成的化合物 |
AD
根据R元素的质量分数进行计算,R的相对原子质量/32=27.27%/72.73%,得R的相对原子质量为12,即碳元素,是第二周期ⅣA族的元素,A对。碳元素形成的气态氢化物很多,甲烷、乙烷、乙烯、乙炔等,所以含H量有很多个值,B错。RO2与水反应生成碳酸,是弱酸,C错。石油的成分主要是烷烃、环烷烃等烃,D对。故选AD

练习册系列答案
相关题目
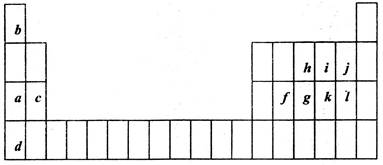

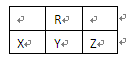
 物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 KBrO3
KBrO3
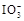 +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在