题目内容
15.利用你学过的化学知识分析,下列反应的化学方程式错误的是( )| A. | 2KNO3+S+3C═K2S+N2↑+3CO2↑ | |
| B. | 2KMnO4+3H2O2+3H2SO4═2K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 5KI+KIO3+6HCl═6KCl+3I2+3H2O | |
| D. | 4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑ |
分析 在氧化还原反应中氧化剂得到的电子数等于还原剂失去的电子数,结合原子守恒分析.
解答 解:A.2KNO3+S+3C═K2S+N2↑+3CO2↑反应中得失电子守恒、原子守恒,故A正确;
B.2KMnO4+3H2O2+3H2SO4═2K2SO4+2MnSO4+4O2↑+6H2O反应中,K元素不守恒,故B错误;
C.5KI+KIO3+6HCl═6KCl+3I2+3H2O反应中得失电子守恒、原子守恒,故C正确;
D.4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑反应中得失电子守恒、原子守恒,故D正确.
故选B.
点评 本题考查了氧化还原反应,侧重于原子守恒和电子守恒的应用的考查,注意把握氧化还原反应中电子守恒的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5. 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
Mn元素价电子排布式为3d54s2,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为TiO2.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.(1)下列叙述正确的是AD.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于d区.
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为TiO2.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为H<C<N<O.
②与CNO-互为等电子体微粒的化学式为CO2或N2O或SCN-(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式N≡C-O-H.
6.常温下甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,下列推断中正确的是( )
| A. | 甲中由水电离产生的H+的物质的量浓度是乙的10倍 | |
| B. | 物质的量浓度c(甲)=10c(乙) | |
| C. | 中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V (甲) | |
| D. | 甲中的c(OH-)为乙中的c(OH-)的10倍 |
3.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-.向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多可能有( )
| A. | 3种或4种 | B. | 3种或5种 | C. | 4种或5种 | D. | 4种或6种 |
10.下列说法正确的是( )
| A. | pH=3的盐酸和pH=11的氨水等体积混合pH=7 | |
| B. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合pH<7 | |
| C. | pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合pH>7 | |
| D. | 取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为0.005mol•L-1 |
20.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析不正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量小于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 |
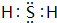 ,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol
,1molC的氢化物与足量的C的氧化物反应,转移的电子的物质的量为2mol