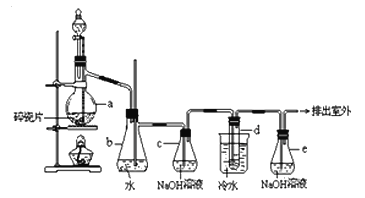
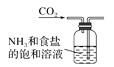
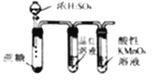
题目内容
【题目】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
I.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3 =______(用含ΔH1 、ΔH2 的代表式表示)。
II.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS_____0(填“>”、“=”、“<”),该反应的ΔH____0(填“>”、“<”)。
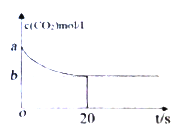
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,温度T下,CO2物质的量浓度c(CO2)随时间t变化的曲线如下图所示。下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)温度T下,反应前20秒的平均速率v(H2)= _________(用含a、b的代数式表示)。
(4)温度T下,该反应的平衡常数K=_________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)_________;CO2转化率_________(填“增大”“减小”或“不变”)。
III.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括_________和H++HCO3-=CO2↑+H2O。
②简述CO32-在阴极区再生的原理:_________。
【答案】 2ΔH1-ΔH2 < < A、D (a-b)/5mol/(L·s) ![]() 减小 增大 4OH--4e-=2H2O+ O2↑ 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32- 再生。
减小 增大 4OH--4e-=2H2O+ O2↑ 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32- 再生。
【解析】试题分析:以CO2的捕集利用技术为题材,重点考查盖斯定律、化学反应进行的方向、化学反应速率、化学平衡的建立、化学平衡的移动、平衡常数、电解原理等知识,考查考生应用已有知识解决实际问题的能力。
解析:Ⅰ.根据盖斯定律,反应3等于2×反应1 –反应2,所以ΔH3=2ΔH1-ΔH2。正确答案:2ΔH1-ΔH2 。
Ⅱ.(1)这是一个气体体积减小的反应,所以反应熵变ΔS<0。因为温度升高时,平衡体系H2的体积分数增大,即平衡逆向移动,所以正反应为放热反应,ΔH<0。(2)A 、反应正向进行时,气体物质的量减小,反应逆向进行时,气体物质的量增大。当容器体积不变时,二者都会导致体系压强改变,所以体系压强不变的状态也一定是化学平衡状态,A正确。B、由于反应进行过程中气体的质量始终保持不变,容器体积不变时,混合气体密度始终不变,所以混合气体体积不变时不一定是化学平衡状态,B错误。C、反应开始时只有CO2和H2,所以生成的CH4与H2O物质的量之比始终为1:2,则CH4与H2物质的量之比保持不变时不一定是化学平衡状态,C错误。D、反应正向进行时H2质量分数减小,反应逆向进行时H2质量分数增大,所以H2质量分数不变时,一定是该反应处于化学平衡状态,D正确。正确答案:AD。(3)前20秒△c(CO2)=(a-b)mol/L,则v(CO2)=![]() ,v(H2)=
,v(H2)= ![]() 。正确答案:
。正确答案:![]() (4)平衡建立过程中,反应消耗CO2 (a-b)mol/L,则参加反应的H2为 4(a-b)mol/L,生成CH4 (a-b)mol/L、H2O 2(a-b) mol/L,所以反应达到平衡时,CO2 bmol/L,H2 [a-4(a-b)]mol/L=(4b-3a)mol/L ,CH4 (a-b) mol/L,H2O 2(a-b) mol/L,
(4)平衡建立过程中,反应消耗CO2 (a-b)mol/L,则参加反应的H2为 4(a-b)mol/L,生成CH4 (a-b)mol/L、H2O 2(a-b) mol/L,所以反应达到平衡时,CO2 bmol/L,H2 [a-4(a-b)]mol/L=(4b-3a)mol/L ,CH4 (a-b) mol/L,H2O 2(a-b) mol/L,![]() 。正确答案:
。正确答案:![]() 。(5)温度降低时,化学反应速率减小,重新建立平衡后,v(正)也减小。由于该反应是放热反应,降低温度后平衡正向移动,所以CO2的转化率增大。正确答案:减小、增大。Ⅲ.K2CO3溶液吸收CO2生成KHCO3,溶液中存在的离子包括K+、H+、HCO3-、CO32-、OH-。①电解时还原性最强的OH-在阳极放电生成O2,反应原理为4OH--4e-=2H2O+O2↑,反应的OH-来源于水,所以电解时阳极产生H+,H++HCO3-=CO2↑+H2O。②阴极区氧化性最强的H+放电生成H2,H+主要来源于水,所以电解时阴极产生OH-,OH-+HCO3-=H2O+CO32-,使CO32-得到再生。正确答案:4OH--4e-=2H2O+O2↑、 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32- 再生。
。(5)温度降低时,化学反应速率减小,重新建立平衡后,v(正)也减小。由于该反应是放热反应,降低温度后平衡正向移动,所以CO2的转化率增大。正确答案:减小、增大。Ⅲ.K2CO3溶液吸收CO2生成KHCO3,溶液中存在的离子包括K+、H+、HCO3-、CO32-、OH-。①电解时还原性最强的OH-在阳极放电生成O2,反应原理为4OH--4e-=2H2O+O2↑,反应的OH-来源于水,所以电解时阳极产生H+,H++HCO3-=CO2↑+H2O。②阴极区氧化性最强的H+放电生成H2,H+主要来源于水,所以电解时阴极产生OH-,OH-+HCO3-=H2O+CO32-,使CO32-得到再生。正确答案:4OH--4e-=2H2O+O2↑、 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32- 再生。

【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
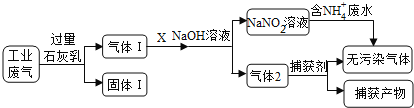
(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。