题目内容
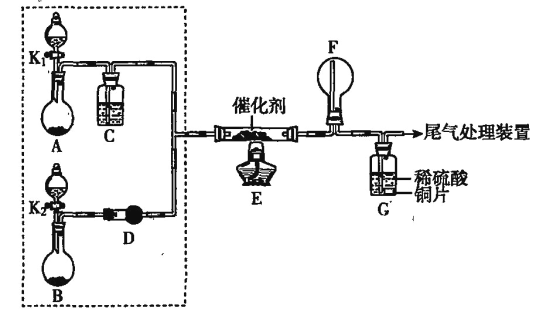
【题目】图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
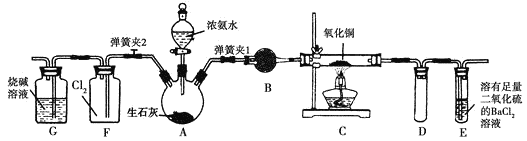
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先_______,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是_______。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生___________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:_______________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是______________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:___________________,迅速产生倒吸的原因是___________________________。
【答案】关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水 碱石灰(或生石灰) 白色沉淀 2NH3+3CuO![]() 3Cu+N2+3H2O Cu2O、Cu 3Cl2+8NH3=N2+6NH4Cl 盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸
3Cu+N2+3H2O Cu2O、Cu 3Cl2+8NH3=N2+6NH4Cl 盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸
【解析】
A装置中浓氨水与生石灰作用制备NH3,B是干燥NH3的装置,C是NH3与CuO的反应装置,E是处理NH3的尾气装置,F是NH3与Cl2的反应装置。
(1)根据题给检查A~E装置的气密性的操作和现象,本题采用加热法检查气密性,所以加热之前,首先进行的操作为:关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,在E中装入水。
(2)装置A中浓氨水与生石灰作用产生的NH3中混有H2O(g),装置B的作用用于干燥NH3,盛放的试剂是碱石灰(或生石灰)。
(3)装置C中黑色固体逐渐变红,则CuO被还原成Cu;装置E中溶液里出现大量气泡,从E中逸出液面的气体可以直接排入空气,则NH3被氧化成N2,即装置C中CuO与NH3发生氧化还原反应生成红色的Cu、N2和H2O,C中发生反应的化学方程式为2NH3+3CuO![]() 3Cu+N2+3H2O;E中吸收多余NH3,E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl,E中还能观察到的现象是产生白色沉淀;
3Cu+N2+3H2O;E中吸收多余NH3,E中发生反应:2NH3+BaCl2+SO2+H2O=BaSO3↓+2NH4Cl,E中还能观察到的现象是产生白色沉淀;
(4)n(CuO)=16g÷80g/mol=0.2mol;若CuO全被还原成Cu,则m(Cu)=0.2mol×64g/mol=12.8g,即固体质量减少3.2g;若CuO全被还原成Cu2O,则m(Cu2O)=0.1mol×144g/mol=14.4g,即固体质量减少1.6g;由于固体质量减少2.4g,则固体产物的成分为Cu、Cu2O;
(5)装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,说明Cl2与NH3反应产生固体NH4Cl,Cl2被还原,则NH3被氧化成N2,反应的化学方程式为3Cl2+8NH3=N2+6NH4Cl;迅速产生倒吸的原因是:盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致瓶内压强减小,引起溶液倒吸。

【题目】下列实验操作完全正确的是()
编号 | 实验 | 操作 |
A | 用浓硫酸配制一定浓度的稀硫酸 | 准确量取浓硫酸,将浓硫酸溶于水后,立刻转移到容量瓶中。 |
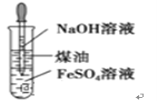
B | 制取氢氧化亚铁沉淀 |
|
C | 量取盐酸溶液 | 用50 mL量筒量取4.0 mol/L的盐酸5.62 mL |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
A.AB.BC.CD.D