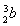题目内容
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
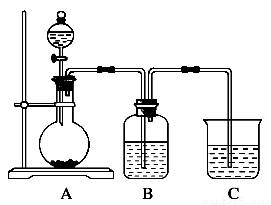
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________________,C中可观察到的现象是________。
(2)B装置的作用是__________________________________________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:_______________________________________。
(5)C装置的作用是_________________________________________________________。
(6)实验结论:氧化性:____________________,非金属性:____________________。
(1)CaCO3+2H+=Ca2++CO2↑+H2O 溶液变浑浊
(2)除去二氧化碳中混有的硝酸蒸气
(3)HNO3>H2CO3>H2SiO3 N>C>Si
(4)Cl2+2Br-=Br2+2Cl-
(5)吸收尾气,防止氯气污染环境
(6)Cl2>Br2 Cl>Br
【解析】(1)A中硝酸与碳酸钙反应产生二氧化碳:CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,碳酸的酸性比硅酸强,发生反应:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓,因此C中产生白色沉淀或溶液变浑浊。
(2)由于硝酸具有挥发性,为避免硝酸与硅酸钠反应而干扰二氧化碳与硅酸钠溶液反应,必须净化二氧化碳,利用饱和碳酸氢钠溶液吸收硝酸蒸气。
(3)由实验现象可知三种酸中,硝酸酸性最强,硅酸酸性最弱;由此推知,氮的非金属性最强,硅的非金属性最弱。在元素周期表中,氮和碳位于同一周期,碳与硅位于同一主族,由此可以推出同主族、同周期非金属元素性质的递变规律。
(4)题目已限制探究氯与溴的非金属性强弱,所以B中应装溴化钾或溴化钠溶液。
(5)由于尾气中含有氯气,故要用碱溶液吸收,以避免污染环境。
(6)根据置换反应可得出单质的氧化性强弱。